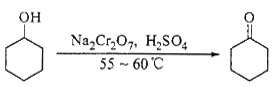题目内容
随着不断向化工、石油、电力、海水淡化、建筑、日常生活用品等行业推广,钛金属日益被人们重视,被誉为“现代金属”和“战略金属”,是提高国防装备水平不可或缺的重要战略物资。工业主要以二氧化钛为原料冶炼金属钛。
Ⅰ.二氧化钛可由以下两种方法制备:
方法1:可用含有Fe2O3的钛铁矿(主要成分为FeTiO3,其中Ti元素化合价为+4价)制取,其主要流程如下:
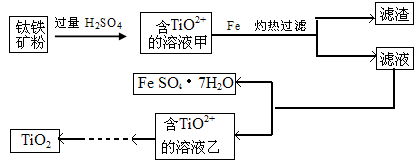
(1)由滤液获得绿矾晶体的操作过程是 。
(2)甲溶液中除含TiO2+之外还含有的金属阳离子有 。
(3)已知10kg该钛铁矿中铁元素的质量分数为33.6%,能够得到绿矾晶体22.24kg,试计算最少加入铁粉的质量。
方法2:TiCl4水解生成TiO2·XH2O,过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2,此方法制备得到的是纳米二氧化钛。
(4)①TiCl4水解生成TiO2·XH2O的化学方程式为 。
②检验TiO2·XH2O中Cl-是否被除净的方法是 。
Ⅱ.二氧化钛可用于制取钛单质
(5)TiO2制取单质Ti,涉及到的步骤如下:
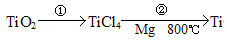
反应②的化学方程式是 ,该反应成功需要的其他条件及原因是 。
Ⅰ.二氧化钛可由以下两种方法制备:
方法1:可用含有Fe2O3的钛铁矿(主要成分为FeTiO3,其中Ti元素化合价为+4价)制取,其主要流程如下:

(1)由滤液获得绿矾晶体的操作过程是 。
(2)甲溶液中除含TiO2+之外还含有的金属阳离子有 。
(3)已知10kg该钛铁矿中铁元素的质量分数为33.6%,能够得到绿矾晶体22.24kg,试计算最少加入铁粉的质量。
方法2:TiCl4水解生成TiO2·XH2O,过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2,此方法制备得到的是纳米二氧化钛。
(4)①TiCl4水解生成TiO2·XH2O的化学方程式为 。
②检验TiO2·XH2O中Cl-是否被除净的方法是 。
Ⅱ.二氧化钛可用于制取钛单质
(5)TiO2制取单质Ti,涉及到的步骤如下:
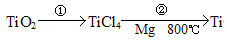
反应②的化学方程式是 ,该反应成功需要的其他条件及原因是 。
(1)冷却、结晶、过滤
(2)Fe3+ 、Fe2+
(3)1.12kg
(4)①TiCl4 + (x+2)H2O(过量)
 TiO2·xH2O↓ + 4HCl
TiO2·xH2O↓ + 4HCl ②取最后一次洗涤液少量,滴加硝酸酸化的AgNO3溶液,不产生白色沉淀,说明Cl-已除净。
(5)
 稀有气体保护,防止高温下Mg(Ti)与空气中的O2(或CO2、N2)作用
稀有气体保护,防止高温下Mg(Ti)与空气中的O2(或CO2、N2)作用试题分析:(1)滤液中含有的溶质是FeSO4,要从中得绿矾晶体的操作过程是蒸发浓缩、冷却、结晶,最后过滤即得到固体就是绿矾。(2)钛铁矿中含有Fe2O3当加入过量的硫酸溶解时,Fe2O3与硫酸反应产生Fe2 (SO4)3,因此该溶液中含有的阳离子为Fe3+ 、Fe2+、TiO2+、H+。则除含TiO2+之外还含有的金属阳离子有Fe3+ 、Fe2+。(3)钛铁矿中铁元素的质量33.6%×10kg=3.36Kg.绿矾晶体22.24kg中含有的Fe元素的质量为22.24kg×(56÷278)=4.48Kg.所以加入的Fe元素的质量为4.48Kg-3.36Kg="1.12Kg." (4)①TiCl4水解生成TiO2·XH2O的化学方程式为TiCl4 + (x+2)H2O(过量)
 TiO2·xH2O↓ + 4HCl. ②检验TiO2·XH2O中Cl-是否被除净的方法是取最后一次洗涤液少量,滴加硝酸酸化的AgNO3溶液,不产生白色沉淀,说明Cl-已除净。(5)根据题意和已知条件可得反应的方程式为
TiO2·xH2O↓ + 4HCl. ②检验TiO2·XH2O中Cl-是否被除净的方法是取最后一次洗涤液少量,滴加硝酸酸化的AgNO3溶液,不产生白色沉淀,说明Cl-已除净。(5)根据题意和已知条件可得反应的方程式为 。因为Mg及反应产生的Ti容易与其它物质发生反应,为防止在高温下它们与空气中的氧气反应,所以该反应成功需要在稀有气体的环境中进行。2的制取方法及以TiO2为原料制取钛单质的反应原理、混合物的分离方法、反应条件的选择。
。因为Mg及反应产生的Ti容易与其它物质发生反应,为防止在高温下它们与空气中的氧气反应,所以该反应成功需要在稀有气体的环境中进行。2的制取方法及以TiO2为原料制取钛单质的反应原理、混合物的分离方法、反应条件的选择。
练习册系列答案
相关题目
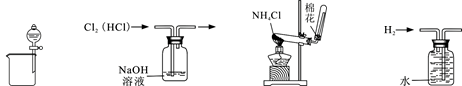
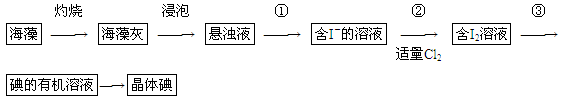 (1)实验操作③的名称是________,所用主要仪器名称为________。
(1)实验操作③的名称是________,所用主要仪器名称为________。