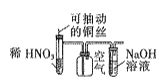
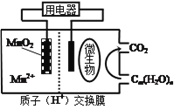
题目内容
【题目】能源是现代文明的原动力,通过化学方法可使能量按人们所期望的形式转化,从而开辟新能源和提高能量转化率。请回答下列问题:
(1)能源危机是当前全球性的问题,“开源节流”是应对能源危机的重要举措。下列做法有助于能源“开源节流”的是_______(填序号)。
a.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b.大力开采煤、石油和天然气以满足人们日益增长的能源需求
c.开发太阳能、水能、风能、地热能等新能源,减少使用煤、石油等化石燃料
d.减少资源消耗,增加资源的重复使用、资源的循环再生
(2)化学反应的本质是旧的化学键断裂,新的化学键形成。已知断开1mo1H-H键、1molN![]() N键、lmolN-H键分别需要吸收的能量为436kJ、946kJ、391kJ。那么生成1mo1 NH3需___________(填“放出”或“吸收”)__________kJ 的热量。
N键、lmolN-H键分别需要吸收的能量为436kJ、946kJ、391kJ。那么生成1mo1 NH3需___________(填“放出”或“吸收”)__________kJ 的热量。
(3)已知一定条件下,白磷转化为红磷释放出能量,故白磷比红磷稳定性_____(填“强”、“弱”)
(4)化学电源在生产生活中有着广泛的应用。
①根据构成原电池的本质判断,如下反应可以设计成原电池的是___________。(填序号)
A.NaOH+HCl = NaCl+H2O B.2CO+O2 =2CO2
C.2H2O=2H2↑+O2↑ D.Cu+2AgNO3=2Ag+Cu(NO3)2
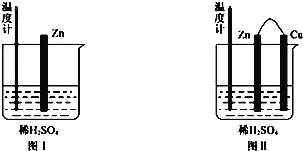
②为了探究化学反应中的能量变化,某同学设计了如下两个实验(如下图)。有关实验现象,下列说法正确的是:_____(填序号)
A.图I和图II的气泡均产生于锌棒表面
B.图II中产生气体的速率比I快
C.图I中温度计的示数高于图II的示数
D.图I和图II中温度计的示数相等,且均高于室温
③燃料电池是一种高效、环境友好的供电装置。以甲醇(CH3OH)为燃料的电池中,电解质溶液为碱性,负极的反应式为:_______________________________,若该电池的效率为60%,当外电路转移1.2mol电子,消耗的氧气的体积为_________________ L(标准状况)
【答案】acd 吸收 46 弱 BD BC 2CH3OH-12e﹣+16OH﹣=12H2O+2CO32- 11.2
【解析】
(1)“开源节流”主要从可再生发展能源考虑;
(2)依据化学反应的反应热与化学键之间的关系计算;
(3)能量越低越稳定;
(4)①从原电池反应必须是自发的氧化还原反应的角度分析;
②图Ⅰ锌和稀硫酸反应生成硫酸锌和氢气;稀硫酸和锌的反应是放热反应导致溶液温度逐渐升高;图Ⅱ该装置构成原电池,Zn易失电子作负极,Cu作正极,正极上氢离子得电子生成氢气;温度计指示的温度变化不明显,说明化学能没有全部转化为热能,大多数转化为电能,据此作答;
③甲醇(CH3OH)燃料电池,负极发生氧化反应,结合电解质为碱性书写电极反应式;氧气在正极得电子,根据转移电子数与参与氧气的关系解答。
(1)a. 沼气是可再生能源,大力发展农村沼气,符合开源节流思想,A项正确;
b. 煤、石油、天然气都是化石燃料,是不可再生的,所以大力开采煤、石油和天然气不符合源节流思想,B项错误;
c. 开发太阳能、水能、风能、地热能等新能源,减少使用煤、石油等化石燃料,能够解决能源危机,符合开源节流思想,C项正确;
d. 减少资源消耗,增加资源的重复利用、资源的循环再生,提高了资源利用率,能够缓解能源危机,符合开源节流思想,D项正确。
答案选acd;
(2)依据化学方程式N2+3H2![]() 2NH3可知,生成1mol NH3放出的热量等于断开0.5mol N2与 1.5mol H2所吸收的热量与生成1mol NH3放出的热量的差值,即△H =0.5×946kJ/mol+3/2×436kJ/mol-3×391kJ/mol = —46 kJ/moL,该反应为放热反应,即生成1mo1 NH3需放出46 kJ 的热量,。
2NH3可知,生成1mol NH3放出的热量等于断开0.5mol N2与 1.5mol H2所吸收的热量与生成1mol NH3放出的热量的差值,即△H =0.5×946kJ/mol+3/2×436kJ/mol-3×391kJ/mol = —46 kJ/moL,该反应为放热反应,即生成1mo1 NH3需放出46 kJ 的热量,。
故答案为:放出;46;
(3)已知一定条件下,白磷转化为红磷释放出能量,则说明白磷比红磷能量高,稳定性弱,
故答案为:弱;
(4)①原电池是将化学能转变为电能的装置,只有自发的氧化还原反应才有电子的转移,
A. A为非氧化还原反应,A项错误;
B. 可做燃料电池,B项正确;
C. 为氧化还原反应,但是C反应不能自发,故不能设计成原电池,C项错误;
D. 为自发的氧化还原反应,D项正确;
故答案为:BD;
②A. 图Ⅰ锌和稀硫酸反应生成硫酸锌和氢气,离子方程式为Zn+2H+═Zn2++H2↑,气泡产生于锌棒本身,而图Ⅱ该装置构成原电池,Zn易失电子作负极,Cu作正极,正极上氢离子得电子生成氢气,产生气泡的是铜棒,A项错误;
B. 构成的原电池可加快化学反应速率,则图II中产生气体的速率比I快,B项正确;
C. 温度计指示的温度变化不明显,说明化学能没有全部转化为热能,大多数转化为电能,图I中温度计的示数高于图II的示数,C项正确;
D. 两装置中的离子方程式均为Zn+2H+═Zn2++H2↑,为放热反应,但由于原电池散热多,导致图I中温度计的示数高于图II的示数,D项错误;
故答案为:AC;
③甲醇(CH3OH)在碱性电解质中,失电子发生氧化反应生成碳酸根离子,所以负极反应式为:2CH3OH-12e﹣+16OH﹣=12H2O+2CO32-;设消耗的氧气的体积在标砖状况下为VL,则根据O2![]() 4e-可知,
4e-可知,![]() =1.2 mol,解得V=11.2 L,
=1.2 mol,解得V=11.2 L,
故答案为:2CH3OH-12e﹣+16OH﹣=12H2O+2CO32-;11.2 L。

【题目】下表是元素周期表一部分,列出了十种元素在周期表中的位置:
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
3 | ① | ③ | ④ | ⑨ | ||||
4 | ② | ⑩ |
请回答下列问题:
(1)在上述元素中,非金属性最强的是________(填元素名称),原子半径最大的是_____(填元素符号),⑧与⑩两者核电荷数之差是_____________。
(2)①~⑨中元素最高价氧化物对应的水化物中酸性最强的是_______________(填物质化学式)。
<>(3)⑤和⑦可以形成一种温室气体,用电子式表示其形成过程____________________________。(4)表中元素①和⑦可以形成一种淡黄色物质X,写出X的电子式:___________,该物质所含化学键类型为__________________,写出X与水反应的离子方程式_____________________ 0.1mol X与水反应转移电子数为 _______________。
(5)表中元素⑥和⑧可形成一种相对分子量为66的共价化合物Y,Y分子中各原子均达到“8电子稳定结构”,Y的结构式为________________________。
【题目】25℃时,用浓度为0.100 0 mol·L-1的氢氧化钠溶液分别滴定20.00 mL浓度均为0.100 0 mol·L-1的二种酸HX、HY(忽略体积变化),实验数据如下表,下列判断不正确的是 ( )
数据编号 | 滴入NaOH(aq)的体积/mL | 溶液的pH | |
HX | HY | ||
① | 0 | 3 | 1 |
② | a | 7 | x |
③ | 20.00 | >7 | y |
A. 在相同温度下,同浓度的两种酸溶液的导电能力:HX<HY
B. 由表中数据可估算出Ka(HX)≈10-5
C. HY和HX混合,c(H+)=c(X-)+c(Y-)+c(OH-)
D. 上述②反应后的HY溶液中:c(Na+)>c(Y-)>c(OH-)>c(H+)