题目内容
I2在KI溶液中存在下列平衡:I2(aq)+I-?I3-(aq).测得不同温度下该反应的平衡常数K如下表:
下列说法正确的是( )
| t/℃ | 5 | 15 | 25 | 35 | 50 |
| K | 1100 | 841 | 680 | 533 | 409 |
| A.反应I2(aq)+I-?I3-(aq)的△H>0 | ||||
| B.其他条件不变,升高温度,溶液中c(I3-)减小 | ||||
C.该反应的平衡常数表达式是K=
| ||||
| D.25℃时,向溶液中加入少量KI固体,平衡常数K小于680 |
A.由表中数据可知,温度越大平衡常数越小,说明升高温度平衡向逆反应方向移动,故正反应方向为放热反应,即△H<0,故A错误;
B.升高温度平衡向逆反应方向移动,溶液中c(I3-)减小,故B正确;
C.I2(aq)+I-?I3-(aq)平衡常数k=
,故C错误;
D.加入KI固体,平衡向右移动,但平衡常数只受温度影响,与物质的浓度无关,加入少量KI固体,平衡常数K不变,故D错误;
故选B.
B.升高温度平衡向逆反应方向移动,溶液中c(I3-)减小,故B正确;
C.I2(aq)+I-?I3-(aq)平衡常数k=
| c(I3-) |
| c(I2)?c(I-) |
D.加入KI固体,平衡向右移动,但平衡常数只受温度影响,与物质的浓度无关,加入少量KI固体,平衡常数K不变,故D错误;
故选B.

练习册系列答案
相关题目
(2010?广州二模)I2在KI溶液中存在下列平衡:I2(aq)+I-?I3-(aq).测得不同温度下该反应的平衡常数K如下表:
|
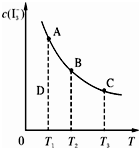 I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I3-(aq).某I2和KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态).下列说法正确的是( )
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I3-(aq).某I2和KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态).下列说法正确的是( )| A、反应I2(aq)+I-(aq)?I3-(aq)的△H<0 | B、若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1<K2 | C、若反应进行到状态D时,一定有v正<v逆 | D、状态A与状态B相比,状态A的c(I2)大 |
 I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I3(aq),某I2、KI混合溶液中,
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I3(aq),某I2、KI混合溶液中, I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)═I3-(aq),某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态).下列说法正确的是( )
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)═I3-(aq),某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态).下列说法正确的是( ) I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I3-(aq),某I2、KI混合溶液中,c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态).下列说法正确的是( )
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I3-(aq),某I2、KI混合溶液中,c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态).下列说法正确的是( )