题目内容
【题目】如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为离子交换膜。
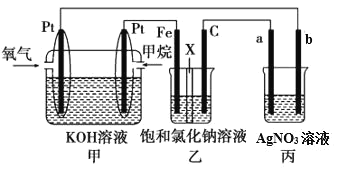
请按要求回答相关问题:
(1)甲烷燃料电池负极电极反应式是:_____。
(2)乙中X是交换膜,工作一段时间后若要恢复成原溶液,应_____。
(3)欲用丙装置给铜镀银,b应是_____(填化学式)。
(4)若乙池中的饱和氯化钠溶液换成一定量CuSO4溶液,通电一段时间后,向所得的溶液中加入0.1molCu(OH)2后恰好恢复到电解前的浓度和pH,则电解过程中转移的电子数为_____mol。(忽略溶液体积的变化)
(5)通过膜电池可除去废水中的乙酸钠和对氯苯酚(![]() ),其原理如图所示,A极的电极反应为____。
),其原理如图所示,A极的电极反应为____。

(6)化学在环境保护中起十分重要的作用,电化学降解法可用于治理水中硝酸盐污染,电化学降解NO3-的原理如图所示。
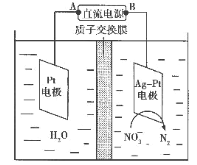
①Ag-Pt电极上的电极反应式为_____。
②若电解过程中转移了2mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为___g。
【答案】CH4-8e-+10OH-=CO32-+7H2O 阳离子通入一定量HCl气体 Ag 0.4 ![]() +H++2e-→Cl-+
+H++2e-→Cl-+![]() 2NO3-+10e-+12H+=N2↑+6H2O 14.4g
2NO3-+10e-+12H+=N2↑+6H2O 14.4g
【解析】
(1)甲烷燃料电池负极上CH4失电子,发生氧化反应,在碱性条件下产物为碳酸钾;
(2)燃料电池通氧气的极为正极,则乙中电解池的阴极为Fe、阳极为C,电解产物为H2、Cl2和NaOH;
(3)丙为电镀池,其中b为阳极,a为阴极,现铜镀银,则应选择Ag为阳极,Cu为阴极;
(4)用C为阳极电解CuSO4溶液,加入0.1mol Cu(OH)2后恰好恢复到电解前的浓度和pH,发生如下电解:2CuSO4+2H2O ![]() 2Cu+O2↑+2H2SO4、2H2O
2Cu+O2↑+2H2SO4、2H2O![]() 2H2↑+O2↑,再根据“析出什么加入什么”的原则分析;
2H2↑+O2↑,再根据“析出什么加入什么”的原则分析;
(5)原电池中阳离子移向正极,根据原电池中氢离子的移动方向可知A为正极,正极有氢离子参与反应;
(6)由题给原理图可知,Ag-Pt电极上NO3-发生还原反应生成N2,则Ag-Pt电极为阴极,则B为负极,A为电源正极,Pt电极为电解池的阳极,电极反应式为:2H2O-4e-=4H++O2↑,据此计算膜两侧电解液的质量变化差。
(1)甲烷燃料电池负极上CH4失电子,发生氧化反应,在碱性条件下产物为碳酸钾,则负极电极反应式是CH4-8e-+10OH-=CO32-+7H2O;
(2)燃料电池通氧气的极为正极,则乙中电解池的阴极为Fe、阳极为C,电解产物为H2、Cl2和NaOH,工作一段时间后若要恢复成原溶液,应通入适量HCl气体,恰好完全中和NaOH即可;
(3)丙为电镀池,其中b为阳极,a为阴极,现铜镀银,则应选择Ag为阳极, Cu为阴极,即b极材料是Ag;
(4)乙池加入0.1mol Cu(OH)2后恰好恢复到电解前的浓度和pH,发生如下电解:2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4、2H2O
2Cu+O2↑+2H2SO4、2H2O![]() 2H2↑+O2↑,Cu(OH)2从组成上可看成CuOH2O,根据“析出什么加入什么”的原则知,析出的物质是氧化铜和水,则阴极上析出氢气和铜,生成0.1mol铜转移电子=0.1mol×2mol=0.2mol,根据原子守恒知,生成0.1mol水需要0.1mol氢气,生成0.1mol氢气转移电子=0.1mol×2mol=0.2mol,所以电解过程中共转移电子数为0.4mol;
2H2↑+O2↑,Cu(OH)2从组成上可看成CuOH2O,根据“析出什么加入什么”的原则知,析出的物质是氧化铜和水,则阴极上析出氢气和铜,生成0.1mol铜转移电子=0.1mol×2mol=0.2mol,根据原子守恒知,生成0.1mol水需要0.1mol氢气,生成0.1mol氢气转移电子=0.1mol×2mol=0.2mol,所以电解过程中共转移电子数为0.4mol;
(5)A为正极,正极有氢离子参与反应,电极反应式为![]() +H++2e-→Cl-+
+H++2e-→Cl-+![]() ;
;
(6)①由题给原理图知,Ag-Pt电极上NO3-发生还原反应,酸性介质中,电极反应式为:2NO3-+10e-+12H+=N2↑+6H2O;
②A为电源正极,Pt电极为电解池的阳极,电极反应式为:2H2O-4e-=4H++O2↑,转移2mol电子时,阳极区消耗1mol水,产生2molH+进入阴极室,阳极室质量减少18g;电极反应式为2NO3-+10e-+12H+=N2↑+6H2O,阴极室中放出0.2molN2(即5.6g),同时有2molH+(即2g)进入阴极室,因此阴极室质量减少5.6g-2g=3.6g,故膜两侧电解液的质量变化差(△m左-△m右)=14.4g。

【题目】某实验小组依据反应![]() 设计如图1原电池,探究pH对AsO4 3-氧化性的影响。测得电压与pH的关系如图2。下列有关叙述不正确的是( )
设计如图1原电池,探究pH对AsO4 3-氧化性的影响。测得电压与pH的关系如图2。下列有关叙述不正确的是( )
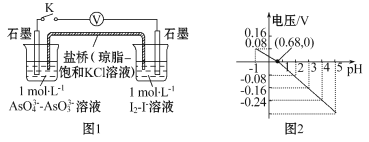
A.调节pH可以改变反应的方向 |
B.pH=0.68时,反应处于平衡状态 |
C.pH=5时, 负极电极反应式为2I--2e -= I2 |
D.pH>0.68时,氧化性I2>AsO43- |