题目内容
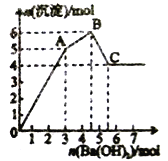
【题目】向FeCl3、Al2(SO4)3的混合溶液中逐滴加入Ba(OH)2溶液,形成沉淀的情况如图所示。
氢氧化物 | 溶液pH | |||
开始沉淀 | 沉淀完全 | 沉淀开始溶解 | 沉淀完全溶解 | |
Fe(OH)3 | 2.3 | 3.4 | - | - |
A1(OH)3 | 3.3 | 5.2 | 7.8 | 12.8 |
A. 据图计算原溶液中c(Cl-)>c(SO42-)
B. C点的沉淀为Fe (OH)3
C. AB段可能发生的反应是:2SO42-+ 2Ba2+ + Al3+ + 3OH- == 2BaSO4↓ + A1(OH)3↓
D. OA段可能发生的反应是:3Ba2+ + 6OH- + 3SO42- + Fe3+ + Al3+ = 3BaSO4↓ + Fe (OH)3↓ + A1(OH)3↓
【答案】D
【解析】图表读出:Fe3+ 在PH=3.4时已沉淀完全,Al3+ 在PH=3.3时才形始沉淀,分析可知铁离子先沉淀,SO42―从一开如就沉淀,离子方程式为:Ba2++SO42-═BaSO4↓,Fe3++3OH-=Fe (OH)3↓,Al3++3OH-═ A1(OH)3↓, A1(OH)3+OH-═AlO2-+2H2O,1molAl2(SO4)3中SO42-完全被沉淀所需Ba(OH)2的物质的量为3mol,提供6molOH-,由图象分析,OA段为加入3molBa(OH)2 ,发生Ba2++SO42-═BaSO4↓,得3molBaSO4沉淀,C点为氢氧化铝被溶解后的沉淀,为氢氧化铁和硫酸钡沉淀共4mol,所以氢氧化铁沉淀1mol,氢氧化铝沉淀2mol;从而判断OA段沉淀3mol钡离子,1mol铁离子和1mol铝离子;AB段为沉淀1mol铝离子;BC段为溶解氢氧化铝消耗氢氧化钡1mol。
A、据图象分析:FeCl3、Al2(SO4)3的混合溶液含1molFeCl3、,含1molAl2(SO4)3,c(Cl-)=c(SO42-),故A错误;B、分析可知,C点沉淀为BaSO4 和Fe (OH)3,故B错误;C、分析可知:1molAl2(SO4)3中SO42-完全被沉淀所需Ba(OH)2量为3mol,含6molOH-,铁离子先沉淀,OA段为加入3molBa(OH)2,发生Ba2++SO42-═BaSO4↓,得3molBaSO4沉淀,C点为氢氧化铁和硫酸钡沉淀共4mol,氢氧化铁沉淀为1mol,氢氧化铝沉淀为2mol;分析判断OA段沉淀3mol钡离了,1mol铁离子和1mol铝离子;AB段为沉淀1mol铝离子;AB段发生的反应可能是Al3++3OH-=Al(OH)3 ↓,也可能是部分Fe3++3OH-=Fe (OH)3↓,故C错误;D、OA段可能发生的反应有沉淀钡离子,铁离子,铝离子,反应为,3Ba2++6OH-+3SO42-+Al3++Fe3+=3BaSO4↓+Fe(OH)3 ↓+Al(OH)3 ↓,也可能发生3Ba2++6OH-+3SO42-+2Fe3+=3BaSO4↓+2Fe(OH)3 ↓,故D正确;故选D。