题目内容
CO、CH4均为常见的可燃性气体。
(1)等体积的CO和CH4在相同条件下分别完全燃烧,转移的电子数之比是_____________。
(2)已知在101 kPa时,CO的燃烧热为283 kJ·mol-1。相同条件下,若2 mol CH4完全燃烧,生成液态水,所放出的热量为1 mol CO完全燃烧放出热量的6.30倍,CH4完全燃烧反应的热化学方程式是______________________________________。
(3)120 ℃、101 kPa下,a mL由CO、CH4组成的混合气体在b mL O2中完全燃烧后,恢复到原温度和压强。
①若混合气体与O2恰好完全反应,产生b mL CO2,则混合气体中CH4的体积分数为_____________(保留2位小数)。
②若燃烧后气体体积缩小了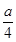 mL,则a与b关系的数学表示式是____________。
mL,则a与b关系的数学表示式是____________。
(1)1∶4
(2)CH4(g)+2O2(g)="===" CO2(g)+2H2O(l) ΔH="-891" kJ·mol-1
(3)①0.33 ②b≥
【解析】
试题分析:(1)CO和CH4充分燃烧:
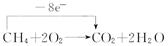
转移电子数之比为2∶8,即1∶4。
(2)1 mol CH4燃烧生成液态水,放出的热量为: ="891"
kJ,所以热化学方程式为:CH4(g)+2O2(g)
="891"
kJ,所以热化学方程式为:CH4(g)+2O2(g) CO2(g)+2H2O(l)
ΔH="-891" kJ·mol-1。
CO2(g)+2H2O(l)
ΔH="-891" kJ·mol-1。
(3)①设混合气体中CO、CH4的体积分别为x、y,
2CO + O2====2CO2
x x/2 x
CH4 + 2O2 CO2+2H2O
CO2+2H2O
y 2y y
有方程组:
求得:x= a,y=
a,y= a
a
②CH4燃烧前后气体体积不变,则缩小 mL都是由CO燃烧造成的,各物质的体积关系如下:
mL都是由CO燃烧造成的,各物质的体积关系如下:
2CO + O2====2CO2 ΔV
2 1 1
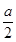 mL
mL  mL
mL  mL
mL
CH4
+ 2O2 CO2+2H2O
CO2+2H2O
1 2
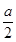 mL
a mL
mL
a mL
即混合气体中CO、CH4均为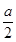 mL,要保证这些气体全部燃烧,至少需要O2
mL,要保证这些气体全部燃烧,至少需要O2 mL,也就是b≥
mL,也就是b≥ 。
。
考点:考查氧化还原反应的有关计算、热化学方程式的书写以及根据方程式进行的有关计算
点评:该题综合性强,难度较大,主要是考查学生分析问题、灵活运用基础知识解决实际问题的能力。有助于培养学生的严谨的逻辑思维能力和抽象思维能力,也有利于提高学生的规范答题能力和应试能力。该题的难点在于(3)问,学生不易得分。

 通城学典默写能手系列答案
通城学典默写能手系列答案