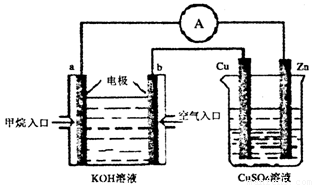
题目内容
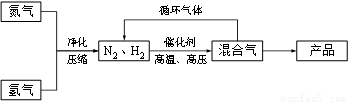
工业上合成氨是在一定条件下进行如下反应:
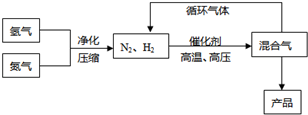
N2(g)+3H2(g)?2NH3(g),△H=-92.44kJ/mol;其部分工艺流程如下:
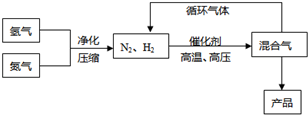
反应体系中各组分的部分性质见下表:
| 气体 | 氮气 | 氢气 | 氨 |
| 熔点(℃) | -210.01 | -252.77 | -77.74 |
| 沸点(℃) | -195.79 | -259.23 | -33.42 |
(1)写出该反应的化学平衡常数表达式:K=______.随着温度的升高,K值______(填增大、减小、不变).
(2)平衡常数K值越大,表明______(填序号).
A.N2的转化率越高 B.NH3的产率越大
C.原料中N2的含量越高 D.化学反应速率越快
(3)合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程.即反应后通过把混合气体的温度降低到______使______分离出来;继续循环的气体是______.
解:(1)平衡常数K= =
=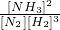 ,根据反应N2(g)+3H2(g)?2NH3(g),△H=-92.44kJ/mol,可知反应是放热反应,随着温度的升高,K减小,故答案为:
,根据反应N2(g)+3H2(g)?2NH3(g),△H=-92.44kJ/mol,可知反应是放热反应,随着温度的升高,K减小,故答案为: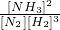 ;减小;
;减小;
(2)平衡常数K值越大,说明化学方应向右进行的彻底,反应物的转化率越高,生成物NH3的产率越大,故选AB;
(3)根据题意可知氨气的沸点是-33.42,可以将温度降低到-33.42,让氨气分离出来,氢气和氮气可以再循环利用,故答案为:-33.42;NH3;N2、H2.
分析:(1)平衡常数K= ,对于吸热反应,随着温度的升高,K增大,对于放热反应,随着温度的升高,K减小;
,对于吸热反应,随着温度的升高,K增大,对于放热反应,随着温度的升高,K减小;
(2)平衡常数表示化学方应进行的彻底程度;
(3)减少生成物的浓度,化学平衡向着正向移动,氨气易液化,
点评:本题是一道关于化学平衡的题目,可以根据所学知识进行回答,难度不大.
 =
=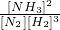 ,根据反应N2(g)+3H2(g)?2NH3(g),△H=-92.44kJ/mol,可知反应是放热反应,随着温度的升高,K减小,故答案为:
,根据反应N2(g)+3H2(g)?2NH3(g),△H=-92.44kJ/mol,可知反应是放热反应,随着温度的升高,K减小,故答案为: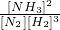 ;减小;
;减小;(2)平衡常数K值越大,说明化学方应向右进行的彻底,反应物的转化率越高,生成物NH3的产率越大,故选AB;
(3)根据题意可知氨气的沸点是-33.42,可以将温度降低到-33.42,让氨气分离出来,氢气和氮气可以再循环利用,故答案为:-33.42;NH3;N2、H2.
分析:(1)平衡常数K=
 ,对于吸热反应,随着温度的升高,K增大,对于放热反应,随着温度的升高,K减小;
,对于吸热反应,随着温度的升高,K增大,对于放热反应,随着温度的升高,K减小;(2)平衡常数表示化学方应进行的彻底程度;
(3)减少生成物的浓度,化学平衡向着正向移动,氨气易液化,
点评:本题是一道关于化学平衡的题目,可以根据所学知识进行回答,难度不大.

练习册系列答案
相关题目
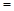 2NO(g) ΔH
2NO(g) ΔH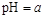 ,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH__________
,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH__________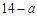 (填“大于”、“小于”或“等于”)。
(填“大于”、“小于”或“等于”)。 2NH3(g)回答下列问题:
2NH3(g)回答下列问题: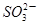 )+c(
)+c(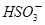 )+c(H2SO3)]=c(
)+c(H2SO3)]=c(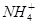 )+c(NH3·H2O)
)+c(NH3·H2O)