题目内容
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 3.0g 质量分数为46%的乙醇水溶液中所含的原子数目为0.6NA
B. 23 g C2H6O分子中含C—H键数目为2.5NA
C. 0.3 mol Na2O2固体中含自由移动的离子总数为0.9NA
D. 将CO2通过Na2O2使其增重a g时,反应中转移电子数为![]()
【答案】BD
【解析】
A. 3.0g 质量分数为46%的乙醇水溶液中含有的乙醇的物质的量为0.03mol,0.03mol乙醇中含有0.27mol原子,由于水分子中同样含有原子,所以该乙醇水溶液中含有的原子数大于0.27mol ,含有原子总数大于0.27NA,故A错误;
B. 23 g C2H6O的物质的量为0.5mol,一个C2H6O分子含有5个C—H键,故0.5mol C2H6O分子中含C—H键数目为2.5NA,故B正确;
C. Na2O2固体中没有自由移动的离子,故C错误;
D.2mol CO2与Na2O2反应生成1mol氧气,过氧化钠质量增重56g,增重a g时生成氧气的物质的量为:a/56mol,转移的电子的物质的量为a/56×2 mol=a/28 mol,反应中转移电子数为![]() ,,故D正确;
,,故D正确;
故选BD。

 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案【题目】利用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备流程,回答下列问题:
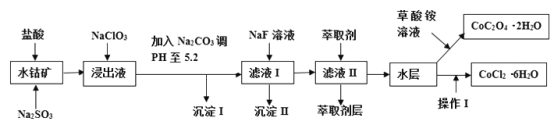
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等;②沉淀I中只含有两种沉淀;③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中Co2O3发生反应的离子反应方程式为_________________。
(2)NaClO3在浸出液中发生的离子反应方程式为______________。
(3)加入Na2CO3调PH至5.2,目的是________;萃取剂层含锰元素,则沉淀II的主要成分为_____。
(4)操作I包括:将水层加入浓盐酸调整PH为2-3,______、_____、过滤、洗涤、减压烘干等过程。
(5)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量硝酸酸化的硝酸银溶液,过滤、洗涤、干燥,测沉淀质量。通过计算发现粗产品中CoCl2·6H2O质量分数大于100%,其原因可能是_____(回答一条原因即可)。






