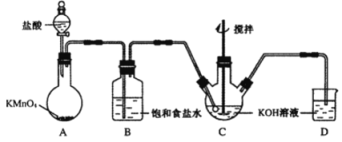
题目内容
【题目】

实验操作Ⅰ:在试管中加入5mL 1mol/L NaOH溶液和5mL 溴乙烷,振荡.
实验操作II:将试管如图固定后,水浴加热.
(1)用水浴加热而不直接用酒精灯加热的原因是 .
(2)观察到 现象时,表明溴乙烷与NaOH溶液已完全反应.
(3)写出溴乙烷与NaOH溶液发生的反应方程式 ,为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,在你设计的实验方案中,需要检验的是 ,检验的方法是 (需说明:所用的试剂、简单的实验操作及预测产生的实验现象).
【答案】(1)溴乙烷沸点低,减少溴乙烷的损失;
(2)试管内溶液静置后不分层;
(3)CH3CH2Br+NaOH![]() CH3CH2OH+NaBr;生成的气体;将生成的气体先通过盛有水的试管,再通入盛有KMnO4溶液的试管,KMnO4溶液褪色(或直接通入溴的四氯化碳溶液).
CH3CH2OH+NaBr;生成的气体;将生成的气体先通过盛有水的试管,再通入盛有KMnO4溶液的试管,KMnO4溶液褪色(或直接通入溴的四氯化碳溶液).
【解析】试题分析:(1)水浴加热,可提供稳定的加热温度,且避免溴乙烷的挥发;
(2)溴乙烷不溶于水,开始溶液分层,生成物乙醇、溴化钠都溶于水;
(3)溴乙烷与NaOH溶液发生水解反应生成乙醇和溴化钠;溴乙烷在NaOH乙醇溶液中发生消去反应,生成乙烯,乙烯能够使酸性的高锰酸钾褪色(或者使溴的四氯化碳褪色),只要证明乙烯的存在即可证明发生的是消去反应.
解:(1)溴乙烷沸点低,溴乙烷易挥发,用水浴加热热均匀,减少溴乙烷的损失.
故答案为:溴乙烷沸点低,减少溴乙烷的损失;
(2)溴乙烷不溶于水,开始溶液分层,生成物乙醇、溴化钠都溶于水,当溶液分层消失,表明溴乙烷与NaOH溶液已完全反应.
故答案为:试管内溶液静置后不分层;
(3)溴乙烷与NaOH溶液发生水解反应生成乙醇和溴化钠,反应的方程式为CH3CH2Br+NaOH![]() CH3CH2OH+NaBr,溴乙烷在NaOH乙醇溶液中发生消去反应,生成乙烯,只有证明乙烯的存在即可证明发生的是消去反应,方法是:将生成的气体先通过盛有水的试管,再通入盛有酸性KMnO4溶液的试管,酸性KMnO4溶液褪色(或直接通入溴的四氯化碳溶液,四氯化碳褪色),
CH3CH2OH+NaBr,溴乙烷在NaOH乙醇溶液中发生消去反应,生成乙烯,只有证明乙烯的存在即可证明发生的是消去反应,方法是:将生成的气体先通过盛有水的试管,再通入盛有酸性KMnO4溶液的试管,酸性KMnO4溶液褪色(或直接通入溴的四氯化碳溶液,四氯化碳褪色),
故答案为:CH3CH2Br+NaOH![]() CH3CH2OH+NaBr;生成的气体;将生成的气体先通过盛有水的试管,再通入盛有KMnO4溶液的试管,KMnO4溶液褪色(或直接通入溴的四氯化碳溶液).
CH3CH2OH+NaBr;生成的气体;将生成的气体先通过盛有水的试管,再通入盛有KMnO4溶液的试管,KMnO4溶液褪色(或直接通入溴的四氯化碳溶液).