题目内容
6.H2S在金属离子的鉴定分析、煤化工等领域都有重要应用.请回答:Ⅰ、工业上一种制备H2S的方法是在催化剂、高温条件下,用天然气与SO2反应,同时生成两种能参与大气循环的氧化物.
(1)该反应的化学方程式为4SO2+3CH4═4H2S+3CO2+2H2O.
II.H2S可用于检测和沉淀金属阳离子.
(2)H2S的第一步电离方程式为H2S?H++HS-.
(3)己知:25℃时,Ksp(SnS)=1.0×10-25,Ksp(CdS)=8.0×10-27,该温度下,向浓度均为0.1mol•L-1的CdCl2和SnCl2的混合溶液中通人H2S,当Sn2+开始沉淀时,溶液中c(Cd2+)=8.0×10-3mol/L(溶液体积变化忽略不计).
Ⅲ.H2S是煤化工原料气脱硫过程的重要中间体.反应原理为:
ⅰ.COS(g)+H2(g)?H2S(g)+CO(g)△H=+7kJ•mol-1;
ⅱ.CO(g)+H2O(g)?CO2(g)+H2(g)△H=-42kJ•mol-1;
(4)己知:断裂1mol分子中的化学键所需吸收的能量如下表所示.
| 分子 | COS(g) | H2(g) | CO(g) | H2S(g) | H2O(g) | CO2(g) |
| 能量/kJ•mol-1 | 1319 | 442 | x | 678 | -930 | 1606 |
(5)向10L容积不变的密闭容器中充入1mol COS(g)、1mol H2(g)和1mol H2O(g),进行上述两个反应.其他条件不变时,体系内CO的平衡体积分数与温度(T)的关系如图所示.

①随着温度升高,CO的平衡体积分数增大(填“增大”或“减小”),原因为反应I为吸热反应,升高温度,平衡正向移动,CO的平衡体积分数增大;反应II为放热反应,升高温度,平衡逆向移动,CO的平衡体积分数也增大.
②T1℃时,测得平衡时体系中COS的物质的童为0.80mol.则该温度下,COS的平衡转化率为20%;反应i的平衡常数为0.044(保留两位有效数字).
分析 I.(1)工业上一种制备H2S的方法是在催化剂、高温条件下,用天然气与SO2反应,同时生成两种能参与大气循环的氧化物,从元素角度考虑,这两种氧化物为CO2和H2O,反应产生H2S;
II.(2)H2S的第一步电离产生H+和HS-,是不完全电离;
(3)根据溶度积常数计算;
III.(4)根据盖斯定律计算,△H=反应物总键能-生成物总键能;
(5)①根据方程式和图象分析,升高温度,CO的平衡体积分数增大,升高温度使化学反应平衡向吸热方向进行;
②T1℃时,测得平衡时体系中COS的物质的量为0.80mol,此时CO的平衡体积分数为5%,根据方程式计算COS的平衡转化率,将各组分平衡浓度代入平衡常数表达式计算反应i的平衡常数.
解答 解:I.(1)工业上一种制备H2S的方法是在催化剂、高温条件下,用天然气与SO2反应,同时生成两种能参与大气循环的氧化物,从元素角度考虑,这两种氧化物为CO2和H2O,反应产生H2S,则该反应的化学方程式为:4SO2+3CH4═4H2S+3CO2+2H2O,
故答案为:4SO2+3CH4═4H2S+3CO2+2H2O;
II.(2)H2S的第一步电离产生H+和HS-,是不完全电离,则H2S的第一步电离方程式为:H2S?H++HS-,
故答案为:H2S?H++HS-;
(3)向浓度均为0.1mol/L的CdCl2和SnCl2的混合溶液中通人H2S,当Sn2+开始沉淀时,溶液中c(S2-)=$\frac{{K}_{sp}(SnS)}{c(S{n}^{2+})}$=$\frac{1.0×1{0}^{-25}}{0.1}$=1.0×10-24mol/L,则溶液中c(Cd2+)=$\frac{{K}_{sp}(CdS)}{c({S}^{2-})}$=$\frac{8.0×1{0}^{-27}}{1.0×1{0}^{-24}}$=8.0×10-3mol/L,
故答案为:8.0×10-3mol/L;
III.(4)根据反应i:COS(g)+H2(g)?H2S(g)+CO(g)△H=+7kJ/mol,根据盖斯定律,△H=1319+442-678-x=7,可得x=1076,
故答案为:1076;
(5)①根据方程式和图象分析,升高温度,CO的平衡体积分数增大,升高温度使化学反应平衡向吸热方向进行,反应i为吸热反应,升高温度,化学平衡向正反应方向进行,CO的体积分数增大,反应ii为放热反应,升高温度化学平衡向逆反应方向移动,CO的体积分数增大,综合两个反应考虑,CO的体积分数随着温度升高而增大,
故答案为:增大;反应i为吸热反应,升高温度,平衡正向移动,CO的平衡体积分数增大;反应ii为放热反应,升高温度,平衡逆向移动,CO的平衡体积分数也增大;
②T1℃时,测得平衡时体系中COS的物质的量为0.80mol,此时CO的平衡体积分数为5%,反应起始时,向10L容积不变的密闭容器中充入1mol COS(g)、1mol H2(g)和1mol H2O(g),则COS的平衡转化率为α=$\frac{1-0.80}{1}×100%$=20%,
反应i的方程式:COS(g)+H2(g)?H2S(g)+CO(g),
起始(mol) 1 1 0 0
转化(mol) 0.2 0.2 0.2 0.2
平衡(mol) 0.8 0.8 0.2 0.2
反应ii的方程式:CO(g)+H2O(g)?CO2(g)+H2(g)
起始(mol) 0.2 1 0 0.8
转化(mol) x x x x
平衡(mol) 0.2-x 1-x x 0.8+x
CO的平衡体积分数为5%,则0.2-x=3×5%,可得x=0.05,则平衡时c(COS)=$\frac{0.8mol}{10L}$=0.08mol/L,c(H2)=$\frac{0.8+0.05}{10}mol/L$=0.085mol/L,c(H2S)=$\frac{0.2mol}{10L}$=0.02mol/L,c(CO)=$\frac{0.2-0.05}{10}mol/L$=0.015mol/L,因此反应i的化学平衡常数为K1=$\frac{c({H}_{2}S)c(CO)}{c({H}_{2})c(COS)}$=$\frac{0.02mol/L×0.015mol/L}{0.085mol/L×0.08mol/L}$=0.044,
故答案为:20%;0.044.
点评 本题考查化学原理部分知识,包含氧化还原反应方程式的书写和配平,盖斯定律的应用,弱电解质的电离平衡,化学平衡的移动,化学平衡常数的计算,多重反应的计算是难点和易错点,试题有助于培养综合分析问题的能力,为高频考点和常见题型,题目难度中等,是中档题.

| A. | 纤维素、蔗糖、葡萄糖和脂肪在一定条件下都可发生水解反应 | |
| B. | 加热、强酸、强碱、重金属盐、乙醇等均可使蛋白质变性 | |
| C. | 酶具有很强的催化作用,胃蛋白酶只能催化蛋白质的水解,348K时活性更强 | |
| D. | 为检验皂化反应进行程度,取几滴反应液,滴入装存热水的试管中,振荡,若有油滴浮在液面上,说明油脂已完全反应 |
| A. | 某吸热反应能自发进行,因此该反应是熵增反应 | |
| B. | 加压改变反应速率的原因是加压可以改变活化分子的百分数 | |
| C. | 对应某一可逆反应外界条件发生变化,只要平衡发生移动平衡常数一定变化 | |
| D. | 增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率 |
| A. | 容量瓶 | B. | 试管 | C. | 烧瓶 | D. | 烧杯 |
 .
. ;
; ;
; 所含官能团的名称是碳碳双键,醛基;该有机物发生加聚反应后,所得产物的结构简式为
所含官能团的名称是碳碳双键,醛基;该有机物发生加聚反应后,所得产物的结构简式为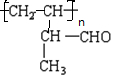 ;
; 工业上烟气脱氮的原理 NO(g)+NO2(g)+2NH3(g)?2N2(g)+3H2O(g)+Q(Q>0)
工业上烟气脱氮的原理 NO(g)+NO2(g)+2NH3(g)?2N2(g)+3H2O(g)+Q(Q>0) ;其空间构型为三角锥形;它常用来生产化肥 NH4Cl.NH4Cl 溶液显酸性;
;其空间构型为三角锥形;它常用来生产化肥 NH4Cl.NH4Cl 溶液显酸性;