题目内容
据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实,其反应的化学方程式为:2CO2(g)+6H2(g)?(g)+3H2O(g). 下列叙述正确的是( )
分析:A.未指明正、逆反应速率,不能判断反应是否到达平衡状态;
B.平衡向正反应移动,不一定是改变温度引起平衡的移动;
C.增大压强平衡向气体体积减小的方向移动,据此判断;
D.氢原子之间形成化学键释放能量,据此判断.
B.平衡向正反应移动,不一定是改变温度引起平衡的移动;
C.增大压强平衡向气体体积减小的方向移动,据此判断;
D.氢原子之间形成化学键释放能量,据此判断.
解答:解:A.若表示不同方向的正、逆反应速率,则反应到达平衡,若为同一方向速率,则反应始终按此关系进行,不能说明到达平衡,故A错误;
B.平衡常数只受温度影响,温度不变平衡常数不变,平衡向正反应移动,不一定是改变温度引起平衡的移动,故平衡常数不一定增大,故B错误;
C.该反应正反应是气体体积减小的反应,增大压强平衡向正反应移动,可提高CO2和H2的转化率,故C正确;
D.氢原子结合生成氢气分子,氢原子之间形成化学键释放能量,2mol氢原子所具有的能量高于1 mol氢分子所具有的能量,故D错误;
故选C.
B.平衡常数只受温度影响,温度不变平衡常数不变,平衡向正反应移动,不一定是改变温度引起平衡的移动,故平衡常数不一定增大,故B错误;
C.该反应正反应是气体体积减小的反应,增大压强平衡向正反应移动,可提高CO2和H2的转化率,故C正确;
D.氢原子结合生成氢气分子,氢原子之间形成化学键释放能量,2mol氢原子所具有的能量高于1 mol氢分子所具有的能量,故D错误;
故选C.
点评:本题考查化学平衡状态判断、化学平衡的影响因素、化学平衡常数、化学反应热效应等,难度不大,A选项为易错点,容易忽略正、逆速率,注意理解外界条件对化学平衡及平衡常数的影响.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
 CH3CH2OH(g)+3H2O(g) 下列叙述错误的是( )
CH3CH2OH(g)+3H2O(g) 下列叙述错误的是( )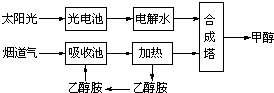
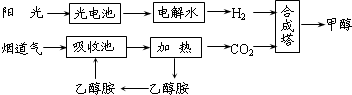
 CH3CH2OH(g)+3H2O(g)
下列叙述错误的是
CH3CH2OH(g)+3H2O(g)
下列叙述错误的是