题目内容
【题目】氯气用途广泛,但在使用时,一般会产生氯化氢。工业上可用O2将HCl转化为Cl2,以提高效益,减少污染。反应为:O2(g)+4HCl(g) ![]() 2Cl2(g)+2H2O(g)
2Cl2(g)+2H2O(g)
完成下列填空:
(1)实验测得P0压强下,HCl平衡转化率α(HCl)随反应温度T的变化如图1所示,则正反应是____________反应(填“吸热”或者“放热”)。
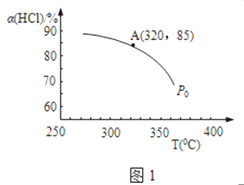
(2)该反应在P0、320°C条件下进行,达平衡状态A时,测得容器内n(Cl2)=7.2×10-3mol,则此时容器中的n(HCl) =_____________mol。
(3)对该反应达到平衡后,以下分析正确的是____________________(选填编号)。
a.增加n(HCl),对正反应的反应速率影响更大
b.体积不变加入稀有气体,对正反应的反应速率影响更大
c.压强不变加入稀有气体,对逆反应的反应速率影响更大
d.如果平衡常数K值增大,对逆反应的速率影响更大
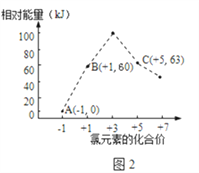
(4)氯元素能形成多种离子.在水溶液中1molCl-、1mol ClOx-(x=1,2,3,4)能量的相对大小如图2所示,写出B→A+C反应的热化学方程式(用离子符号表示)____________________;若有1.5molB发生反应,转移电子______mol。
【答案】 放热 2.54×10-3 ad 3ClO—(aq) = ClO3—(aq) + 2Cl—(aq) ΔH= -117 kJ·mol-1 2
【解析】(1)、O2(g)+4HCl(g) ![]() 2Cl2(g)+2H2O(g)的平衡常数k=
2Cl2(g)+2H2O(g)的平衡常数k= ![]() ;升高温度平衡向吸热的方向移动,根据图知,温度升高,氯化氢的转化率下降,即平衡逆向移动,所以该反应的正反应为放热反应,
;升高温度平衡向吸热的方向移动,根据图知,温度升高,氯化氢的转化率下降,即平衡逆向移动,所以该反应的正反应为放热反应,
故答案为:放热。
(2)、设反应中氯化氢的起始的物质的量为amol,反应在P0、320°C条件下进行,达平衡状态A时,氯化氢的转化率为85%,即有85%amol的氯化氢反应生成氯气的物质的量为
0.5×85%×amol=7.2×10-3mol,所以a=1.69×10-2,所以平衡时容器中的n(HCl)=15%×amol=2.54×10-3mol,故答案为:2.54×10-3。
(3)、a.增加n(HCl),平衡正向移动,即对正反应的反应速率影响更大,故a正确;
b.体积不变加入稀有气体,各物质的浓度不变,所以平衡不移动,正逆反应速率不变,故b错误;
c.压强不变加入稀有气体,则体积变大,相当于对原平衡体系减压,则平衡向逆反应方向移动,所以正反应的反应速率下降得更多,故c错误;
d.如果平衡常数K值增大,即平衡向正反应方向移动,即正反应速率大于逆反应的速率,由于该反应为放热反应,所以要降低温度,所以逆反应速率下降得要比正反应速率多,故d正确;故选ad;
(4)、B→A+C,根据转移电子守恒得该反应方程式为3ClO-=ClO3-+2Cl-,反应热=(63kJ/mol+2×0kJ/mol)-3×60kJ/mol=-117kJ/mol,所以该热化学反应方程式为3ClO-(aq)=ClO3-(aq)+2Cl-(aq)△H=-117kJ/mol,根据方程式可知,每当有3mol的ClO-反应,可转移电子4mol,所以若有1.5molClO-发生反应,转移电子为2mol
故答案为:3ClO-(aq)=ClO3-(aq)+2Cl-(aq)△H=-117 kJ·mol-1;2。

【题目】相同温度下体积均为2L的两个恒容容器中发生可逆反应:2SO2(g)+O2(g)![]() 2SO3(g) △H=-196kJ·mol-1,实验测得有关数据如下表:
2SO3(g) △H=-196kJ·mol-1,实验测得有关数据如下表:
容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
SO2 | O2 | SO3 | ||
① | 2 | 1 | 0 | 放热 156.8 kJ |
② | 0.6 | 0.3 | 1.4 | Q(Q>0) |
下列叙述不正确的是
A. 容器①中达到平衡吋,O2的转化率为80%
B. Q=19.6kJ
C. 容器①、②中反应的平衡常数相等,K=80
D. 相同温度下,起始时向容器中充入0.8 mol SO2、0.4 mol O2和3.2 mol SO3,反应达到平衡前v(正)>v(逆)
