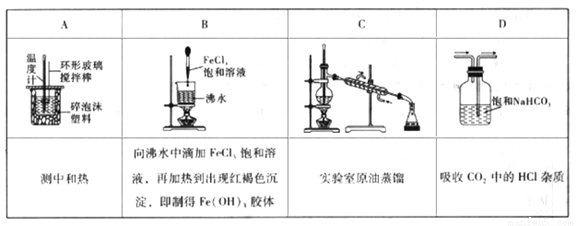
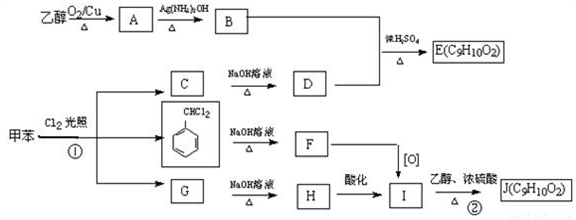
题目内容
已知SO2可以用Fe(NO3)3溶液吸收,按如图所示装置展开相关探究:取一定量的铜片于三颈烧瓶中,通入一段时间N2后再加入足量的浓硫酸,加热;装置A中有白雾(硫酸酸雾)生成,装置B中产生白色沉淀。回答下列问题:

(i)装置A中用于添加浓硫酸的仪器名称为_________________。
(2)实验开始前需进行的操作是_____________________。
(3)加入浓硫酸之前先通入N2一段时间,其目的是_____________________。
(4)排除装置A中白雾影响,可在装置A、B间增加洗气瓶C,则C中盛放的试剂是_______;若用NaOH溶液处理尾气,则发生反应的离子方程式为_________________。
(5)经过讨论,该小组对装置B中产生沉淀的原因,提出下列假设(不考虑各因素的叠加);假设1:装置A中白雾进入装置B中参与了反应;
假设2:______________;
假设3: Fe(NO3)3溶液显酸性,在此酸性条件下NO3-能氧化SO2。
(6)请你设计实验验证上述假设3,写出实验步骤、预期现象和结论。
实验步骤(简述操作过程) | 预期现象和结论 |
①测1.0mol/LFe(NO3)3溶液的pH ②取与Fe(NO3)3溶液中c(NO3-)相同的适量Ba(NO3)2溶液滴入试管中 (3)________________ ④向试管中通入适量SO2气体 | _____________ |
(7)若假设2正确,请写出B中发生反应的离子方程式:_________________。
练习册系列答案
相关题目





 2NH3(g)合成氮气。对于气相反应,用某组份(B)的平衡压强(PB)代替物质的量浓度(CB)也可以表示平衡常数(记作Kp),且PB=P×B的体积分数。则该反应的化学平衡常数表达式(Kp)是_____。恒温恒压下,在一容积可变的容器中,该反应达到平衡状态时,N2、H2、NH3各1mol,若此时再充入3molN2,则平衡_________移动(填“正向”、“逆向”或“不”)。
2NH3(g)合成氮气。对于气相反应,用某组份(B)的平衡压强(PB)代替物质的量浓度(CB)也可以表示平衡常数(记作Kp),且PB=P×B的体积分数。则该反应的化学平衡常数表达式(Kp)是_____。恒温恒压下,在一容积可变的容器中,该反应达到平衡状态时,N2、H2、NH3各1mol,若此时再充入3molN2,则平衡_________移动(填“正向”、“逆向”或“不”)。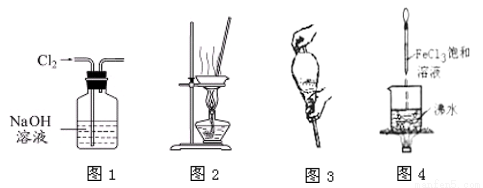
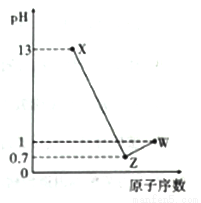

 HFeCl4 。试回答下列问题:
HFeCl4 。试回答下列问题: