题目内容
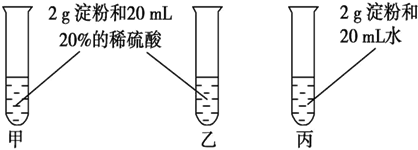
16.锌钡白是一种白色颜料.工业上是由ZnSO4与BaS溶液混合而成:BaS+ZnSO4=ZnS↓+BaSO4↓.请根据以下工业生产流程(图1)回答有关问题.Ⅰ、ZnSO4溶液的制备与提纯:
有关资料:a.菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等;
b.Zn(OH)2与Al(OH)3相似,能溶于过量的NaOH溶液生成Na2ZnO2.
(1)②中使用的氧化剂最好是下列的D(选填字母代号).
A.Cl2B.浓HNO3C.KMnO4D.H2O2
(2)为了达到综合利用、节能减排的目的,上述流程步骤④中的CO2可以来自于步骤①(选填①、②、③、⑤).
(3)写出步骤②加入氧化剂反应的离子方程式2Fe2++H2O2+2H+=2Fe3++2H2O.
(4)与Al相似,Zn也能溶于NaOH溶液.写出将Zn片和Cu片放入NaOH溶液中形成原电池的负极电极反应式:Zn-2e-+4OH-=ZnO22-+2H2O.
Ⅱ、BaS溶液的制备:(图2)
有关数据:Ba(s)+S(s)+2O2(g)═BaSO4(s)△H1=-1473.2kJ•mol-1
C(s)+$\frac{1}{2}$O2(g)═CO(g)△H2=-110.5kJ•mol-1
Ba(s)+S(s)═BaS(s)△H3=-460kJ•mol-1
(5)若BaSO与煤粉(主要成份是碳)煅烧还原的产物仅为BaS和CO,则其反应的热化学方程式为:BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H=+571.2 kJ•mol-1.
Ⅲ、制取锌钡白:
(6)如果生产流程步骤⑤硫酸过量,则ZnSO4与BaS溶液混合制取锌钡白产生的后果是过量的酸与BaS溶液混合会产生有毒的H2S污染空气,而且会降低锌钡白的产率.
分析 I、由图1流程可知,菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等,加硫酸,只有SiO2不反应,经过过滤进行分离,则滤渣1为SiO2,滤液1含有硫酸铜、硫酸亚铁、硫酸锌、剩余的硫酸,②加氧化剂将亚铁离子氧化为铁离子,再加过量的NaOH,Zn2+转化ZnO22-,使Cu2+、Fe3+转化为沉淀,通过过滤从溶液中除去,则滤渣2为Fe(OH)3、Cu(OH)2,滤液2中含有Na2ZnO2及过量的NaOH,④通二氧化碳将ZnO22-转化为沉淀,则滤渣3为Zn(OH)2,步骤⑤主要发生氢氧化锌与硫酸的反应,滤液3含有碳酸氢钠.
(1)加氧化剂将亚铁离子氧化为铁离子,不能引入新杂质;
(2)上述各步骤中,只有步骤①中有二氧化碳生成;
(3)氧化剂双氧水将亚铁离子氧化为铁离子,得到的还原产物是水,据此书写离子方程式;
(4)Zn与NaOH溶液反应,Zn作负极,发生氧化反应失去电子,碱性条件下生成ZnO22-与H2O;
Ⅱ、(5)煅烧发生反应:BaSO4+C$\frac{\underline{\;高温\;}}{\;}$BaS+4CO↑,根据已知热化学方程式乘以适当的系数进行加减构造目标热化学方程式;
Ⅲ、(6)步骤⑤中硫酸过量,过量的酸与BaS溶液混合会发生反应,产生有毒的H2S污染空气,而且会降低锌钡白的产率.
解答 解:I、由图1流程可知,菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等,加硫酸,只有SiO2不反应,经过过滤进行分离,则滤渣1为SiO2,滤液1含有硫酸铜、硫酸亚铁、硫酸锌、剩余的硫酸,②加氧化剂将亚铁离子氧化为铁离子,再加过量的NaOH,Zn2+转化ZnO22-,使Cu2+、Fe3+转化为沉淀,通过过滤从溶液中除去,则滤渣2为Fe(OH)3、Cu(OH)2,滤液2中含有Na2ZnO2及过量的NaOH,④通二氧化碳将ZnO22-转化为沉淀,则滤渣3为Zn(OH)2,步骤⑤主要发生氢氧化锌与硫酸的反应,滤液3含有碳酸氢钠.
(1)加氧化剂将亚铁离子氧化为铁离子,不能引入新杂质,氯气做氧化剂会引入氯离子,且氯气有毒,浓HNO3做氧化剂会被还原为有毒气体,引入杂质离子NO3-,KMnO4 做氧化剂会引入K+、MnO4-,过氧化氢做氧化剂被还原为水,不引入新的杂质,过量的过氧化氢加热分解生成氧气和水,
故选:D;
(2)上述各步骤中,只有步骤①中有二氧化碳生成,
故选:①;
(3)硫酸锌、硫酸亚铁以及硫酸铜的混合溶液中,加氧化剂双氧水将亚铁离子氧化为铁离子,以便于步骤③除去,反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(4)Zn与NaOH溶液反应,Zn作负极,发生氧化反应失去电子,碱性条件下生成ZnO22-与H2O,负极电极反应式为:Zn-2e-+4OH-=ZnO22-+2H2O,
故答案为:Zn-2e-+4OH-=ZnO22-+2H2O;
Ⅱ、(5)煅烧发生反应:BaSO4+C$\frac{\underline{\;高温\;}}{\;}$BaS+4CO↑,
已知:①Ba(s)+S(s)+2O2(g)=BaSO4(s);△H=-1473.2kJ•mol-1
②C(s)+$\frac{1}{2}$O2(g)=CO(g);△H=-110.5kJ•mol-1
③Ba(s)+S(s)=BaS(s);△H=-460kJ•mol-1
依据盖斯定律,②×4-③-①得到热化学方程式为:BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H=+571.2 kJ•mol-1,
故答案为:BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H=+571.2 kJ•mol-1;
Ⅲ、(6)步骤⑤中硫酸过量,过量的酸与BaS溶液混合会发生反应,产生有毒的H2S污染空气,而且会降低锌钡白的产率,
故答案为:过量的酸与BaS溶液混合会产生有毒的H2S污染空气,而且会降低锌钡白的产率.
点评 本题考查物质制备工艺流程,涉及物质的分离提纯、对操作步骤及试剂的分析评价、电极反应式书写、热化学方程式书写等,理解工艺流程原理是解题关键,题目难度中等.

 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案| A. | 用 10 m 量筒量取 5.2 mL盐酸 | |
| B. | 用 100 mL量筒量取 5.2 mL盐酸 | |
| C. | 用托盘天平称取25.02g NaCl | |
| D. | 用100 mL容量瓶配制50 mL 0.1 mol/L的盐酸 |
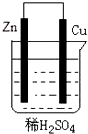 关于如图所示装置的叙述:①Zn为正极,Cu为负极;②溶液中氢离子向负极移动;③电子从锌片经导线流向铜片;④铜极上有氢气产生;⑤若有0.1mol电子流过导线时,锌片质量减轻6.5g;⑥若有1mol电子流过导线,则产生的氢气为0.5mol.正确的是( )
关于如图所示装置的叙述:①Zn为正极,Cu为负极;②溶液中氢离子向负极移动;③电子从锌片经导线流向铜片;④铜极上有氢气产生;⑤若有0.1mol电子流过导线时,锌片质量减轻6.5g;⑥若有1mol电子流过导线,则产生的氢气为0.5mol.正确的是( )| A. | ①②③ | B. | ③④⑤ | C. | ④⑤⑥ | D. | ③④⑥ |
| A. | 离子化合物中可能含有共价键 | |
| B. | 共价化合物中可能含有离子键 | |
| C. | 离子化合物中只含离子键 | |
| D. | 只含共价键的物质一定是共价化合物 |
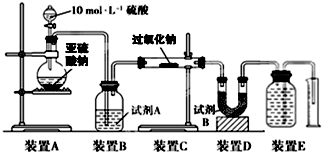 过氧化钠(Na2O2)是中学常见物质,常见的过氧化物还包括过氧化钙(CaO2).已知:过氧化钠与CO2反应有气体生成,而将SO2通入过氧化钠粉末中也有气体生成.有人提出CO2、SO2与过氧化钠的反应原理相同,但也有人提出SO2具有较强的还原性,CO2无强还原性,反应原理不相同.据此设计如下实验操作进行判断.
过氧化钠(Na2O2)是中学常见物质,常见的过氧化物还包括过氧化钙(CaO2).已知:过氧化钠与CO2反应有气体生成,而将SO2通入过氧化钠粉末中也有气体生成.有人提出CO2、SO2与过氧化钠的反应原理相同,但也有人提出SO2具有较强的还原性,CO2无强还原性,反应原理不相同.据此设计如下实验操作进行判断.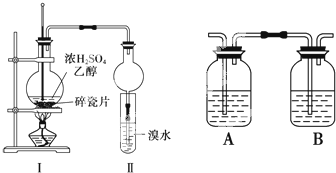 某化学兴趣小组用如图所示装置进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性.
某化学兴趣小组用如图所示装置进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性.