题目内容
18.反应物间进行微粒交换是化学反应的特征之一,置换反应、复分解反应、取代反应都属于反应物间进行微粒交换的化学反应.(1)NaHCO3和NaOH的反应是NaHCO3电离的H+离子和NaOH电离出的Na+离子相互交换的反应.
(2)在浓硫酸作用下,羧酸与醇也是微粒交换的反应,请写出乙酸和乙醇反应的化学方程式:CH3COOH+CH3CH2OH$→_{△}^{催化剂}$H2O+CH3COOCH2CH3.
(3)工业上利用铝热反应用铝粉和MnO2冶炼金属锰,写出化学方程式:4Al+3MnO2$\frac{\underline{\;加热\;}}{\;}$2Al2O3+3Mn.
(4)工业上制取粗硅的反应也是一个置换反应,此反应的反应物中含有三种元素,这三种元素的非金属性由强到弱的顺序为O、C、Si.与硅同周期的某元素,其最高价氧化物既可溶于强酸又可溶于强碱,请写出该氧化物溶于强碱的离子方程式:Al2O3+2OH-=2AlO+H2O.
(5)NH3和Cl2发生置换反应,当NH3过量时,NH3继续与HCl反应.当有3molCl2参与反应时,有2molNH3被氧化.
(6)(NH4)2CO3和H2CO3的反应也进行微粒交换,当往(NH4)2CO3溶液中通入一定量CO2至溶液呈中性时,溶液中HCO3-和NH4+的比值小于(填“大于”“小于”或“等于”)1:1.
分析 (1)NaHCO3和NaOH的反应方程式可以看出,是NaHCO3电离的H+离子和NaOH电离出的Na+离子相互交换的反应;
(2)乙酸和乙醇反应的化学方程式为:CH3COOH+CH3CH2OH$→_{△}^{催化剂}$H2O+CH3COOCH2CH3;
(3)铝和二氧化锰反应生成锰单质;
(4)工业上制取粗硅SiO2+2C$\frac{\underline{\;加热\;}}{\;}$Si+2CO↑;与硅同周期的某元素,其最高价氧化物既可溶于强酸又可溶于强碱,为三氧化二铝;
(5)根据反应方程式分析;3Cl2+8NH3=N2+6NH4Cl;
(6)根据溶液中电荷守恒分析.
解答 解:(1)NaHCO3和NaOH的反应方程为:NaHCO3+NaOH=Na2CO3+H2O,由方程式可以看出,是NaHCO3电离的H+离子和NaOH电离出的Na+离子相互交换的反应,
故答案为:Na+;
(2)乙酸和乙醇在催化剂和加热条件下反应生成CH3COOCH2CH3和水,反应的化学方程式为:CH3COOH+CH3CH2OH$→_{△}^{催化剂}$H2O+CH3COOCH2CH3;
故答案为:CH3COOH+CH3CH2OH$→_{△}^{催化剂}$H2O+CH3COOCH2CH3;
(3)铝和二氧化锰反应生成锰单质,化学方程式:4Al+3MnO2$\frac{\underline{\;加热\;}}{\;}$2Al2O3+3Mn,故答案为:4Al+3MnO2$\frac{\underline{\;加热\;}}{\;}$2Al2O3+3Mn;
(4)工业上制取粗硅SiO2+2C$\frac{\underline{\;加热\;}}{\;}$Si+2CO↑,非金属性由强到弱的顺序为O、C、Si;与硅同周期的某元素,其最高价氧化物既可溶于强酸又可溶于强碱,为三氧化二铝,离子方程式:Al2O3+2OH-=2AlO+H2O,故答案为:Al2O3+2OH-=2AlO+H2O;
(5)NH3和Cl2发生置换反应,方程式为:3Cl2+8NH3=N2+6NH4Cl,根据方程可知有3molCl2反应是,消耗氨气为8mol,但是只有2mol氨气发生变价,所以被氧化的氨气为2mol;故答案为:2;
(6)根据溶液中电荷守恒c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),因为溶液显中性,所以c(H+)=c(OH-),c(NH4+)=2c(CO32-)+c(HCO3-),因此c(HCO3-)<c(NH4+),故答案为:小于.
点评 本题考查了置换反应、复分解反应、取代反应特点,非金属的性质,溶液中的离子浓度比较,题目比较综合,但是难度中等.

 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案| A. | AgNO3溶液的浓度减小 | B. | 阳极上产生O2 | ||
| C. | 转移的电子数为0.02NA个 | D. | 阴极发生了氧化反应 |
| A. | 钡可以从氯化钾溶液中置换出钾 | |
| B. | 钡与冷水剧烈反应置换出氢气 | |
| C. | 钡可以从氯化钠溶液中置换出钠 | |
| D. | 在溶液中钡离子可以氧化金属锌,使之成为锌离子 |
| A. | 加入稀盐酸产生无色气体,将该气体通入澄清石灰水中变浑浊,则一定有CO32- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,则一定有SO42- | |
| C. | 加入稀硝酸无明显现象,再加入硝酸银有白色沉淀产生,则一定有Cl- | |
| D. | 加入Na2CO3 溶液产生白色沉淀,再加盐酸,白色沉淀消失,则一定有Ba2+ |
| A. | 使用可再生资源、用超临界二氧化碳替代有机溶剂、注重原子的经济性、采用低能耗生产工艺等都是绿色化学的内容 | |
| B. | 石油的分馏、煤的气化、海水晒盐、花生中提取花生油等过程都是物理变化 | |
| C. | 利用可降解的“玉米塑料”生产一次性饭盒,可防止白色污染 | |
| D. | 蒙古牧民喜欢用银器盛放鲜牛奶有其科学道理:用银器盛放鲜牛奶,溶入的极微量的银离子,可杀死牛奶中的细菌,防止牛奶变质 |
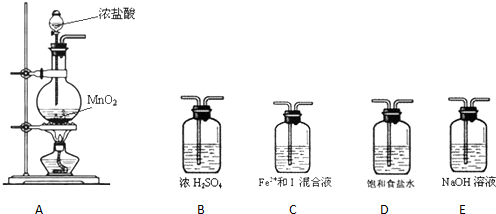
【提出假设】假设1:Fe2+还原性比I-强.假设2:I-还原 性比Fe2+强.假设3:一样强
【验证假设】(1)设计如下几种装置进行实验:
实验 必须的装置是A→C→E(按Cl2气流方向的顺序填写)
(2)实验开始后,控制通入 少量氯气,通过观察混合溶液颜色的变化不能(填“能”或“不能”)判断反应的先后顺序.
(3)请在下表中写出实验步骤及预期现象和结论.
| 实验步骤 | 预期现象和结论 | |
| 取少量反应后的混合溶液分置于A、B两试管中; 往A中滴加KSCN溶液; 往B中滴加淀粉溶液. |
|
【思考与交流】
(5)有同学质疑,上述实验只能验证Cl2分别与Fe2+和I-反应的速率大小,并不能证明Fe2+和I-还原性的强弱.于是提出另一方案:往KI溶液中滴入某溶液,如果能发生反应,即可证明I-的还原性强于Fe2+,该反应的离子方程式是2I-+2Fe3+=I2+2Fe2+.
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.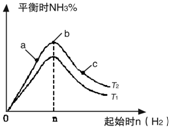 某科研小组研究在其他条件不变的情况下,改变起始氢气物质的量[用n(H2)表示]对N2(g)+3H2(g)?2NH3(g)反应的影响,实验结果可表示成如图所示的规律(图中T表示温度,n表示物质的量):
某科研小组研究在其他条件不变的情况下,改变起始氢气物质的量[用n(H2)表示]对N2(g)+3H2(g)?2NH3(g)反应的影响,实验结果可表示成如图所示的规律(图中T表示温度,n表示物质的量):