题目内容
(江苏省2009届高三化学各地名校月考)工业上目前使用两种方法制取乙醛:(1)乙炔水化法;(2)乙烯氧化法。下列两表提供生产过程中原料、反应条件、原料平衡转化率、产量等有关的信息情况:
表一:原料、反应条件、平衡转化率、日产量
| 乙炔水化法 | 乙烯氧化法 | |
| 原料 | 乙炔、水 | 乙烯、空气 |
| 反应条件 | HgSO4、100~125℃ | PdCl2-CuCl2、100~125℃ |
| 平衡转化率 | 乙炔平衡转化率90%左右 | 乙烯平衡转化率80%左右 |
| 日产量 | 2.5吨(某设备条件下) | 3.6吨(相同设备条件下) |
表二:原料来源生产工艺
| 原料生产工艺过程 | |
| 乙炔 |
|
| 乙烯 | 来源于石油裂解气 |
根据上述两表,回答下列问题:
(1)从两表中分析,现代工业上乙烯氧化法逐步取代乙炔水化法(从环境、原料来源、产率和产量、能耗等角度),分析可能的原因。
(2)若乙烯由石油裂化(裂化气混合气体的平均化学式CnHm、m>2n),进一步完全催化裂解而来,得到体积百分含量分别为:甲烷:5%、乙烯:40%、丙烯:10%、其余为丁二烯和氢气(气体体积均在同温同压下测定)。若得到40mol乙烯,求:能够得到丁二烯和氢气的物质的量各为多少?
(1)氧化法比水化法的反应速率快,(2)28.75、73.75—![]()
解析:
(1)从表一来看,两者反应条件温度相当,但乙炔水化法制乙醛使用的是汞盐催化剂,毒性大;虽然乙烯氧化法的转化率略小于乙炔水化法,但反应快、日产量比其高得多。
从表二来看,乙炔的制取要经过多步反应制得,且消耗大量的热能、电能,较难获得;乙烯来源于石油裂解气,消耗的总能量比乙炔少,且较容易获得。
(2)要得到40molC2H4,则会生成5molCH4、10molC3H6。设生成x mol丁二烯(C4H6)和y molH2,且需要催化裂解a mol的CnHm。
则:根据碳原子守恒:an=5+30+80+4x=115+4 x
根据氢原子守恒:am=20+60+160+6x+2y=240+6x+2y
根据题意:x+y=100-55
解得:x=![]() 或x=
或x=![]() —28.75
—28.75
y=![]() 或y=73.75—
或y=73.75—![]()

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案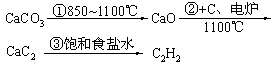
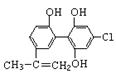
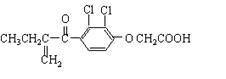
 A.利尿酸分子中有三种含氧官能团,在核磁共振氢谱上共有六个峰
A.利尿酸分子中有三种含氧官能团,在核磁共振氢谱上共有六个峰
 、
、 等
等