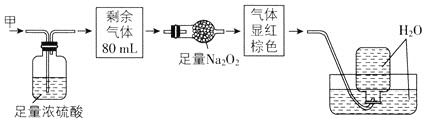
题目内容
【题目】已知:电流效率=电路中通过的电子数÷消耗负极材料失去电子总数。现有三个电池装置如图所示:
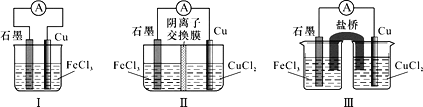
下列说法正确的是
A.Ⅰ、Ⅱ和Ⅲ的电池反应均为:Cu+Fe3+=Cu2++Fe2+
B.Ⅲ中烧杯里的Cl-从右池经过盐桥移向左池
C.5min后,Ⅰ、Ⅱ和Ⅲ中都只含两种溶质
D.Ⅱ、Ⅲ的电流效率均高于Ⅰ的电流效率
【答案】D
【解析】
I、II和III的电池反应均为2Fe3++Cu=Cu2++2Fe2+,Cu电极发生失去电子的氧化反应,为负极,石墨电极为正极,负极反应式为Cu-2e-=Cu2+,正极反应式为2Fe3++2e-=2Fe2+,I电池为单液电池,金属铜和铁离子直接接触,会发生自放电现象,能量损失较大;II电池为采用离子交换膜的双液电池,使金属铜和铁离子之间不接触,减少能量损失,II的电流效率高于I的电流效率;III电池为采用盐桥的双液电池,使金属铜和铁离子之间不接触,减少能量损失,III的电流效率高于Ⅰ的电流效率,据此分析解答。
I、II和III的电池反应均为2Fe3++Cu=Cu2++2Fe2+,Cu电极发生失去电子的氧化反应,为负极,石墨电极为正极,负极反应式为Cu-2e-=Cu2+,正极反应式为2Fe3++2e-=2Fe2+,I电池为单液电池,金属铜和铁离子直接接触,会发生自放电现象,能量损失较大;II电池为采用离子交换膜的双液电池,使金属铜和铁离子之间不接触,减少能量损失,II的电流效率高于I的电流效率;III电池为采用盐桥的双液电池,使金属铜和铁离子之间不接触,减少能量损失,III的电流效率高于Ⅰ的电流效率,
A. Ⅰ、Ⅱ和Ⅲ电池反应相同,总反应均为2Fe3++Cu=Cu2++2Fe2+,A项错误;
B. Ⅲ电池为采用盐桥的双液电池,电池工作时,盐桥中的阴阳离子分别发生定向移动,阳离子进入左池,阴离子进入右池,烧杯里的Cl不移动,B项错误;
C. 根据电池总反应:2Fe3++Cu=Cu2++2Fe2+可知,5min后Ⅰ、Ⅱ中都至少含氯化铜和氯化亚铁2种溶质,Ⅲ电池采用盐桥,盐桥中盐的离子通过定向移动进入左右池,导致Ⅲ中含有两种以上溶质,如盐桥中盐为KCl时,5min后III中至少含氯化铜、氯化亚铁、氯化钾3种溶质,C项错误;
D. 三种电池的工作原理相似,都是将化学能转化为电能的装置,但II电池采用离子交换膜、Ⅲ电池采用盐桥,使金属铜和铁离子之间不接触,减少能量损失,所以Ⅰ的电流效率低于Ⅱ、III的电流效率,D项正确;
答案选D。

 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案【题目】实验室铝热反应的实验装置如下:
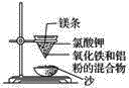
(1)下面放置盛细沙的____________(填名称)。
(2)镁条的作用是______________________________________。
(3)实验现象有:
①________________________________________________________________________;
②________________________________________________________________________;
③________________________________________________________________________。
(4)写出该反应的化学反应方程式:________________,在冶金工业上也常用这一反应原理来冶炼________。
A.不活泼金属 B.较活泼金属
C.稀有金属 D.高熔点金属
(5)已知下表数据:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2054 | 1535 | 1462 |
沸点/℃ | 2467 | 2980 | 2750 |
①某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是该反应放出的热量能使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?________(填“合理”或“不合理”)。
②设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是______________,当观察到___________________现象时,反应的离子方程式是________________________________________________________________________。
③实验室欲溶解此熔融物,最好选用下列试剂中的________(填字母)。
A.浓硫酸 B.稀硫酸
C.稀硝酸 D.NaOH溶液