题目内容
14.掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.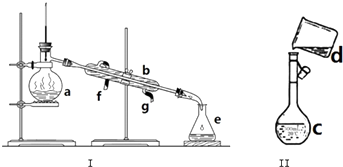
(1)写出下列仪器的名称:b.冷凝管
(2)利用装置I分离四氯化碳和酒精的混合物时,冷凝水由g(填f或g)口通入.
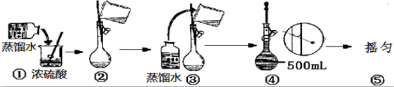
(3)现需配制0.1mol/LNaOH溶液500mL,装置II是某同学转移溶液的示意图.
①图中的错误是未用玻璃棒引流.
②配制溶液时,其正确的操作顺序是(用字母表示,每个字母只能用一次)FEDCBA.
A.将容量瓶盖紧,振荡,摇匀
B.改用胶头滴管加水,使溶液凹面恰好与刻度相切
C.继续往容量瓶内小心加水,直到液面接近刻度2~3cm处
D.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
E.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中
F.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
③配制溶液时下列操作会造成所配溶液浓度偏小的是AC
A.称量后转移固体时不小心把少量固体洒到烧杯外
B.干净的容量瓶又用蒸馏水洗涤了一遍
C.转移过程中不小心把几滴溶液滴在外面
D.加水定容时,俯视容量瓶刻度线读数.
分析 (1)根据仪器的结构特点判断;
(2)水流的方向要与蒸汽的方向相反;
(3)①移液时要用玻璃棒引流;
②根据配制一定物质的量浓度的溶液的步骤是称量、量取、稀释、移液、洗涤、定容、摇匀和装瓶来分析操作顺序;
③分析具体操作对n、V的影响,根据c=分析不当操作对溶液浓度的影响.
解答 解:(1)根据仪器的结构特点可知,b为冷凝管,故答案为:冷凝管;
(2)水流的方向要与蒸汽的方向相反,故水流要由g口进,故答案为:g;
(3)①移液时要用玻璃棒引流,否则溶液会溅出,导致溶质的损失,则答案为:未用玻璃棒引流;
②根据配制一定物质的量浓度的溶液的步骤是称量、量取、稀释、移液、洗涤、定容、摇匀和装瓶可知正确的操作顺序为:FEDCBA,故答案为:FEDCBA;
③A.称量后转移固体时不小心把少量固体洒到烧杯外,会导致溶质的损失,则浓度偏低,故A正确;
B.干净的容量瓶又用蒸馏水洗涤了一遍,对溶液浓度无影响,故B错误;
C.转移过程中不小心把几滴溶液滴在外面,会导致溶质的损失,则浓度偏小,故C正确;
D.加水定容时,俯视容量瓶刻度线读数,则溶液体积偏小,浓度偏高,故D错误.
故选AC.
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,难度不大,掌握公式的运用和配制原理是解题的关键.

练习册系列答案
 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目
4.下列叙述正确的是( )
| A. | 当某可逆反应平衡向正反应方向移动时,反应物的转化率一定增加 | |
| B. | 已知金刚石不如石墨稳定,则石墨转变为金刚石需要放热 | |
| C. | 盐酸与某强碱中和放出的热量随反应物的用量改变而改变,但中和热不变 | |
| D. | S(s)+O2(g)═SO2(g)△H3S(g)+O2(g)═SO2(g)△H4△H3<△H4 |
19.下列金属活动性最强的( )
| A. | Mg | B. | Ag | C. | Cu | D. | Zn |
6.已知25℃时,醋酸、碳酸、次氯酸、氢氟酸和亚硫酸的电离平衡常数分别为
(1)写出H2SO3的电离方程式H2SO3?H++HSO3-,HSO3-?H++SO32-.
(2)在25℃时,相同物质量浓度、相同体积的上述五种酸溶液中,氢离子浓度最大的是H2SO3(填“醋酸”、“碳酸”、“次氯酸”、“氢氟酸”或“亚硫酸”,下同);水电离的氢离子浓度最大的是HClO.
(3)在25℃时,0.1mol•L-1的氢氟酸的电离度=6%;溶液pH的测定可用广泛pH试纸,其操作方法是:把一小块pH试纸放在表面皿(或玻璃片)上,用蘸有HF溶液的玻璃棒点在试纸的中部,试纸变色后与标准比色卡比较,确定溶液的pH;加水稀释该氢氟酸溶液,下列数值增大的是BD.
A.c(F-) B.c(OH-) C.c(H+)•c(OH-) D.c(F-)/c(HF) E.c(F-)/c(HF)•c(OH-)
(4)下列离子方程式中正确的是AC.
A.少量CO2通入次氯酸钠溶液中:CO2+H2O+ClO-═HCO3-+HClO
B.少量SO2通入次氯酸钙溶液中:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO
C.过量SO2通入碳酸钠溶液中:2SO2+H2O+CO32-═2HSO3-+CO2
D.过量CH3COOH加入碳酸钠溶液中:CH3COOH+CO32-═CH3COO-+HCO3-
(5)若反应反应:Cl2+H2O?HCl+HClO达到平衡后,要使HClO浓度增加,可以加入E.
A.Na2SO3 B.H2O C.Na2CO3D.NH3•H2OE.NaHCO3
(6)常温下,0.1mol/L醋酸溶液与0.01mol/L醋酸溶液中的c(H+)分别为A与B,则两者的c(H+)大小关系为:A小于10B.(填“大于”、“等于”、“小于”)
| 弱电解质 | CH3COOH | HClO | HF | H2CO3 | H2SO3 |
| 电离平衡常数 | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka=3.6×10-4 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka1=1.5×10-2 Ka2=1.0×10-7 |
(2)在25℃时,相同物质量浓度、相同体积的上述五种酸溶液中,氢离子浓度最大的是H2SO3(填“醋酸”、“碳酸”、“次氯酸”、“氢氟酸”或“亚硫酸”,下同);水电离的氢离子浓度最大的是HClO.
(3)在25℃时,0.1mol•L-1的氢氟酸的电离度=6%;溶液pH的测定可用广泛pH试纸,其操作方法是:把一小块pH试纸放在表面皿(或玻璃片)上,用蘸有HF溶液的玻璃棒点在试纸的中部,试纸变色后与标准比色卡比较,确定溶液的pH;加水稀释该氢氟酸溶液,下列数值增大的是BD.
A.c(F-) B.c(OH-) C.c(H+)•c(OH-) D.c(F-)/c(HF) E.c(F-)/c(HF)•c(OH-)
(4)下列离子方程式中正确的是AC.
A.少量CO2通入次氯酸钠溶液中:CO2+H2O+ClO-═HCO3-+HClO
B.少量SO2通入次氯酸钙溶液中:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO
C.过量SO2通入碳酸钠溶液中:2SO2+H2O+CO32-═2HSO3-+CO2
D.过量CH3COOH加入碳酸钠溶液中:CH3COOH+CO32-═CH3COO-+HCO3-
(5)若反应反应:Cl2+H2O?HCl+HClO达到平衡后,要使HClO浓度增加,可以加入E.
A.Na2SO3 B.H2O C.Na2CO3D.NH3•H2OE.NaHCO3
(6)常温下,0.1mol/L醋酸溶液与0.01mol/L醋酸溶液中的c(H+)分别为A与B,则两者的c(H+)大小关系为:A小于10B.(填“大于”、“等于”、“小于”)
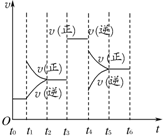 在一密闭容器中发生下列反应:2SO2(g)+O2(g)?2SO3(g)△H<0,如图所示是某一时间段中反应速率与反应进程的曲线关系.回答下列问题:
在一密闭容器中发生下列反应:2SO2(g)+O2(g)?2SO3(g)△H<0,如图所示是某一时间段中反应速率与反应进程的曲线关系.回答下列问题: