��Ŀ����
����Ŀ���о������к�����(��Ҫ��SO2��H2S)��ת��������Ҫ���塣
��1����ʪ��������д��������SO2ת��ΪHSO3��������ʽ�� ��
��3���������������ӽ���Ĥȼ�ϵ�ؿ������ô�������SO2������������װ��ʾ��ͼ���£�
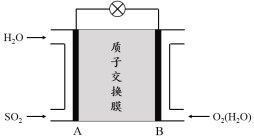
�� ��������������Ϊ ������A��B��������B��A������
�� �������缫��ӦʽΪ ��
��4��ȼú���������������Ǽ�����������������Ⱦ���ؼ���SO2�����ѳ���һ����ҵ�������£�
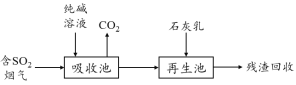
�� �ô�����Һ����SO2����ת��ΪHSO3������Ӧ�����ӷ���ʽ�� ��
�� ��ʯ��������������������Ż����ճأ����п���������SO2�������Ļ�ѧʽ�� ��
���𰸡���1��SO2+H2O![]() H2SO3��H2SO3
H2SO3��H2SO3![]() H++HSO3-
H++HSO3-
��2��H2S(g)+2O2(g)��SO42-(aq)+2H+(aq)��H=��806.39kJ��mol��1
��3������A��B(1��)��SO2�C2e-+2H2O��SO42-+4H+
��4����H2O+2SO2+CO32-��2HSO3-+CO2����NaOH
��������
�����������1����ʪ��������������SO2ת��ΪHSO3-�ķ���ʽΪSO2 + H2O![]() H2SO3��H2SO3
H2SO3��H2SO3![]() H+ + HSO3-��
H+ + HSO3-��
��2������ͼ��������H2S(g)+![]() O2(g)=S(s)+H2O(g) ��H=-221.19kJ/mol����S(s)+
O2(g)=S(s)+H2O(g) ��H=-221.19kJ/mol����S(s)+![]() O2(g)= SO42-(aq) +2H+(aq) ��H =-585.20kJ/mol������+��������H2S(g) + 2O2(g) = SO42-(aq) + 2H+(aq) ��H=-221.19kJ/mol+��-585.20kJ/mol��= ��806.39 kJ/mol��
O2(g)= SO42-(aq) +2H+(aq) ��H =-585.20kJ/mol������+��������H2S(g) + 2O2(g) = SO42-(aq) + 2H+(aq) ��H=-221.19kJ/mol+��-585.20kJ/mol��= ��806.39 kJ/mol��
��3��������ͼʾ��AΪȼ�ϵ�صĸ�����BΪȼ�ϵ�ص���������ԭ��ص��Һ�У�������ɸ����������ƶ�������A��B���ʴ�Ϊ����A��B��
�� ��������������Ӧ��������������Ϊ������������缫��ӦʽΪSO2 �C 2e- + 2H2O��SO42- + 4H+��
��4���� ̼������Һ����SO2�������������ƺͶ�����̼��������Ӧ�����ӷ���ʽΪH2O + 2SO2 + CO32- ��2HSO3- + CO2����
�� �������������ճ�����̼���Ʒ�Ӧ����̼��Ƴ������������ƣ������������ƿ�������SO2��
