题目内容
【题目】下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
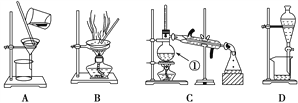
(1)在装置A和装置B中都用到玻璃棒,装置A中玻璃棒的作用是________________,装置B中玻璃棒的作用是________________________防止蒸发皿内溶液因局部过热而溅出。
(2)装置C中①的名称是____________,冷却水的方向是____________。装置D在分液时为使液体顺利滴下,应进行的具体操作是____________________________________。
(3)从氯化钠溶液中得到氯化钠固体,选择装置______(填代表装置图的字母,下同);除去自来水中的Cl-等杂质,选择装置________,检验自来水中Cl-是否除净的方法为;取少量锥形瓶中的水于洁净试管中,滴加_________溶液,不产生白色沉淀表明Cl-已除净;从碘水中分离出I2,选择装置________,该分离方法的名称为________。
【答案】 引流(或使烧杯内的液体沿玻璃棒流入漏斗中) 搅拌 蒸馏烧瓶 下进上出 打开分液漏斗上端的玻璃塞或使凹槽对准小孔 B C 稀硝酸和硝酸银溶液 D 萃取分液
【解析】(1)在装置A和装置B中都用到玻璃棒,装置A中玻璃棒的作用是引流,便于烧杯内的液体沿玻璃棒流入漏斗中;装置B中玻璃棒的作用是搅拌,防止蒸发皿内溶液因局部过热而溅出,故答案为:引流;搅拌;
(2)装置C中仪器①为蒸馏烧瓶,冷却水的方向是下进上出,装置D在分液时为使液体顺利滴下,应进行的具体操作是打开分液漏斗上端的玻璃塞,并使凹槽对准小孔,故答案为:蒸馏烧瓶;下进上出;打开分液漏斗上端的玻璃塞,并使凹槽对准小孔;
(3)从氯化钠溶液中得到氯化钠固体,应该通过蒸发结晶,选择装置B;除去自来水中的Cl-等杂质,应该通过蒸馏,选择装置C,检验自来水中Cl-是否除净的方法为:取少量锥形瓶中的水于洁净试管中,滴加稀硝酸和硝酸银溶液,不产生白色沉淀表明Cl-已除净;从碘水中分离出I2,可以利用苯或四氯化碳萃取碘,选择装置D,该分离方法为萃取分液,故答案为:B;C;稀硝酸和硝酸银溶液;D;萃取分液。

 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案【题目】通过海水晾晒可得粗盐。粗盐除NaCl外,还含有MgCl2、CaCl2以及泥沙等杂质。某同学用某种粗盐进行提纯实验,步骤见下图。请回答下列问题:
![]()

(1)在完成操作Ⅰ之前,必须加入的X物质是___________________。
(2)操作Ⅰ和操作Ⅱ的名称是__________________________。该操作中需要将圆形滤纸折叠处理,下列图示中不该出现的情形是___________________________(填序号)。

(3)在蒸发操作中容易造成食盐固体飞溅,为尽量减少飞溅,除连续搅拌外还可采取_____________________________________________________等措施。
(4)判断加入的盐酸“适量”的方法是_______________________________________________________________________________。
(5)实验所得精盐的质量___________________________(填“大于”、“小于”或“等于”)粗盐中NaCl的质量,原因是_________________________________________________________________________________。
(6)猜想和验证:(并完成相应填空)
猜想 | 验证的方法 | 现象 | 结论 |
猜想Ⅰ:沉淀物A中含CaCO3、MgCO3 | 取少量沉淀物A于试管中,滴加稀盐酸,并用涂有澄清石灰水的小烧杯罩于试管口 | __________ | 猜想Ⅰ成立 |
猜想Ⅱ:沉淀物A中含BaCO3 | 取少量沉淀物A于试管中,先滴入________,再滴入Na2SO4溶液 | 有气泡放出,无白色沉淀 | ______ |
猜想Ⅲ:最后制得的NaCl晶体中还含有Na2SO4 | 取少量NaCl晶体溶于试管中的蒸馏水,____________________ | __________ | 猜想Ⅲ成立 |