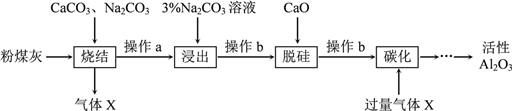
题目内容
【题目】某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行:请根据下面流程,回答以下问题:
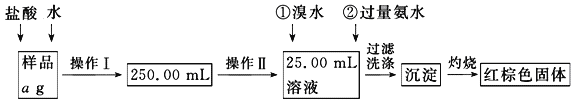
(1)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有___________、___________(填仪器名称),操作Ⅱ必须用到的仪器是___________(填编号)。
A.50 mL烧杯 B.50 mL量筒 C.100 mL量筒 D.25 mL滴定管
(2)请写出加入溴水发生的离子反应方程式_________________,加入氨水要过量的原因是________________。
(3)检验沉淀是否已经洗涤干净的操作是____________________。
(4)若蒸发皿质量是W1 g,蒸发皿与加热后固体总质量是W2 g,则样品中铁元素的质量分数是_________ (列出原始计算式,不需化简);若称量准确,最终测量的结果偏大,则造成误差的原因可能是_________________________。(写出一种原因即可)。
【答案】
(1)250mL容量瓶、量筒、胶头滴管;D;
(2)2Fe2++Br2=2Fe3++2Br-;使Fe3+充分沉淀;
(3)取少量最后一次洗出液,滴加AgNO3溶液,若无沉淀生成,则证明洗涤干净;
(4)![]() ×100%;固体加热时未充分反应变为Fe2O3。
×100%;固体加热时未充分反应变为Fe2O3。
【解析】
试题分析:(1)操作Ⅰ为配制250mL溶液,配制该溶液所需要的仪器有:量筒、胶头滴管、烧杯、玻璃棒、250mL容量瓶,还缺少250mL容量瓶、量筒、胶头滴管,操作Ⅱ是量取25.00mL溶液,选用25 mL滴定管,故答案为:250mL容量瓶、量筒、胶头滴管;D;
(2)因Br2具有氧化性,能氧化Fe2+,反应的离子方程式为:2Fe2++Br2=2Fe3++2Br-;为了使Fe3+充分沉淀,则加入的氨水要过量,故答案为:2Fe2++Br2=2Fe3++2Br-;使Fe3+充分沉淀;
(3)若沉淀没有洗涤干净,滤液中一定含有氯离子,故可通过检验是滤液中否含有氯离子来判断沉淀是否洗涤干净,操作方法为:取少量最后一次洗出液,滴加AgNO3溶液,若无沉淀生成,则证明洗涤干净,故答案为:取少量最后一次洗出液,滴加AgNO3溶液,若无沉淀生成,则证明洗涤干净;
(4)因铁元素质量守恒,即红棕色固体中的铁就是样品中铁,Fe2O3中铁元素的质量为(W2-W1)g×![]() ,样品中铁元素的质量分数为:
,样品中铁元素的质量分数为:![]() ×100%;若氢氧化铁固体加热时未充分反应变为Fe2O3,会导致最终测量的结果偏大,故答案为:
×100%;若氢氧化铁固体加热时未充分反应变为Fe2O3,会导致最终测量的结果偏大,故答案为:![]() ×100%;固体加热时未充分反应变为Fe2O3。
×100%;固体加热时未充分反应变为Fe2O3。

【题目】根据如表所列键能数据,下列分子中最不稳定的分子是( )
化学键 | H﹣H | H﹣Cl | H﹣Br | CI﹣CI | Br﹣Br |
键能( KJmol﹣1) | 436 | 431 | 299 | 247 | 193 |
A.HCl B.HBr C.H2 D.Br2