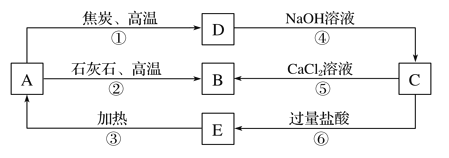
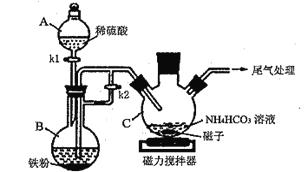
题目内容
【题目】用如图所示装置检验对应气体时,不能达到目的是( )

除杂装置 检验装置
生成的气体 | 试剂 | 试剂 | |
| 电石与水反应制取的乙炔 |
|
|
| 木炭与浓 | 饱和 | 澄清石灰水 |
|
| 水 |
|
|
|
|
|
A. AB. BC. CD. D
【答案】B
【解析】
A项、X中硫酸铜溶液可除去混有的硫化氢,Y中溴的四氯化碳溶液可检验乙炔,故A正确;
B项、木炭与浓![]() 加热反应生成二氧化碳、二氧化硫和水,二氧化硫可与碳酸氢钠反应生成二氧化碳,则不能检验木炭与浓H2SO4加热制取的二氧化碳,X选择不合理,故B错误;
加热反应生成二氧化碳、二氧化硫和水,二氧化硫可与碳酸氢钠反应生成二氧化碳,则不能检验木炭与浓H2SO4加热制取的二氧化碳,X选择不合理,故B错误;
C项、![]() 与NaOH乙醇溶液共热发生消去反应生成乙烯,X中水可除去乙醇,乙烯能被高锰酸钾氧化,Y中
与NaOH乙醇溶液共热发生消去反应生成乙烯,X中水可除去乙醇,乙烯能被高锰酸钾氧化,Y中![]() 酸性溶液褪色可检验乙烯,故C正确;
酸性溶液褪色可检验乙烯,故C正确;
D项、C2H5OH与浓H2SO4加热至170℃发生消去反应生成乙烯,发生副反应生成二氧化碳和二氧化硫,X中![]() 溶液可除去乙醇和二氧化硫,Y中
溶液可除去乙醇和二氧化硫,Y中![]() 的
的![]() 溶液可检验乙烯,故D正确。
溶液可检验乙烯,故D正确。
故选B。

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案【题目】在一定体积的密闭容器中进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=_________________________。
(2)该反应为____________(填“吸热”或“放热”)反应。
(3)能判断该反应达到化学平衡状态的依据是________。
A.容器中压强不变 B.混合气体中c(CO)不变
C.υ正(H2)=υ逆(H2O) D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为________℃。
(5)在800 ℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2 mol·L-1,c(H2)为1.5 mol·L-1,c(CO)为1 mol·L-1,c(H2O)为3 mol·L-1,则下一时刻,反应向________(填“正向”或“逆向”)进行。