题目内容
与下列图像有关的说法正确的是
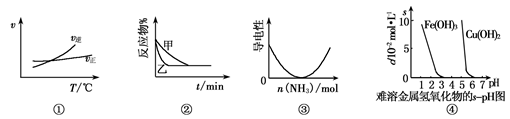
A根据图①可判断A2(g)+3B2(g)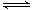 2AB3(g)的ΔH>0
2AB3(g)的ΔH>0
B.图②表示压强对2A(g)+B(g)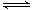 3C(g)的影响,甲的压强大
3C(g)的影响,甲的压强大
C.图③表示乙酸溶液中通入氨气后溶液导电性的变化
D.根据图④,调节溶液的pH 为4即可除去CuSO4溶液中的Fe3+

A根据图①可判断A2(g)+3B2(g)
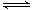 2AB3(g)的ΔH>0
2AB3(g)的ΔH>0B.图②表示压强对2A(g)+B(g)
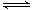 3C(g)的影响,甲的压强大
3C(g)的影响,甲的压强大C.图③表示乙酸溶液中通入氨气后溶液导电性的变化
D.根据图④,调节溶液的pH 为4即可除去CuSO4溶液中的Fe3+
D
A中,V正、V逆交叉点,表示V正=V逆,此时处于平衡状态,继续升温,V逆在上方,V逆>V正,平衡逆向移动,根据勒夏特列原理,升温向吸热方向移动,逆向为吸热,正反应为放热,故△H<0。A错。
B中,D是固体,加压后,平衡不移动,反应物百分含量不变,题中却下降了。B错。
C中,醋酸溶液导电性差,通入氨气,形成醋酸铵,导电能力增强,到一定程度,浓度基本不变,导电性不变。 C错。
D中,根据图④,Fe(OH)3在pH=1开始沉淀,pH=3沉淀完全;Cu(OH)2在pH=5开始沉淀,pH=7沉淀完全;加入CuO调节pH,CuO+2H+=Cu2++H2O,消耗H+,pH增大,到pH=5时,Fe(OH)3沉淀完全,Cu(OH)2刚要沉淀,还未沉淀。D正确。
故本题选D。
B中,D是固体,加压后,平衡不移动,反应物百分含量不变,题中却下降了。B错。
C中,醋酸溶液导电性差,通入氨气,形成醋酸铵,导电能力增强,到一定程度,浓度基本不变,导电性不变。 C错。
D中,根据图④,Fe(OH)3在pH=1开始沉淀,pH=3沉淀完全;Cu(OH)2在pH=5开始沉淀,pH=7沉淀完全;加入CuO调节pH,CuO+2H+=Cu2++H2O,消耗H+,pH增大,到pH=5时,Fe(OH)3沉淀完全,Cu(OH)2刚要沉淀,还未沉淀。D正确。
故本题选D。

练习册系列答案
相关题目
 2NH3(g)+CO2(g)
2NH3(g)+CO2(g)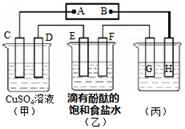
 C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是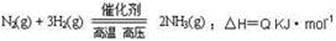
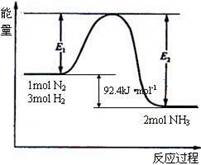
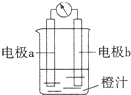
 2NH3(g),若在恒温、恒压条件下向平恒体系中通入氩气,则平衡 移动(填“向左”“向右”或“不”);使用催化剂 反应的△H(填“增大” “减小” 或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平恒体系中通入氩气,则平衡 移动(填“向左”“向右”或“不”);使用催化剂 反应的△H(填“增大” “减小” 或“不改变”)。 H1=" 1175.7" kJ·mol-1
H1=" 1175.7" kJ·mol-1 为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成 沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP [Cu(OH)2]=2.2×10-20。
为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成 沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP [Cu(OH)2]=2.2×10-20。 的代数式表示NH3·H2O的电离常数Kb= 。
的代数式表示NH3·H2O的电离常数Kb= 。 CH3OH(g) ΔH1
CH3OH(g) ΔH1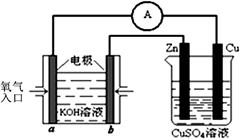

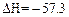 kJ·mol-1,则含Ba(OH)2 1 mol溶液与1 mol稀H2SO4反应放出的热量为114.6 kJ
kJ·mol-1,则含Ba(OH)2 1 mol溶液与1 mol稀H2SO4反应放出的热量为114.6 kJ