题目内容
【题目】25℃时,H2SO3及其钠盐的溶液中,H2SO3、HSO3﹣、SO32﹣的物质的量分数(α)随溶液pH变化关系如图所示,下列叙述错误的是( ) 
A.溶液的pH=5时,硫元素的主要存在形式为HSO3﹣
B.当溶液恰好呈中性时:c(Na+)>c(SO32﹣)+c(HSO3﹣)
C.向pH=8的上述溶液中滴加少量澄清石灰水, ![]() 的值增大
的值增大
D.向pH=3的上述溶液中滴加少量稀硫酸,α(HSO3﹣)减小
【答案】C
【解析】解:A、pH=5时,HSO3﹣的物质的量分数(α)为1.0,说明硫元素的主要存在形式为HSO3﹣,故A正确;
B、c(H+)+c(Na+)=2c(SO32﹣)+c(HSO3﹣)+c(OH﹣),所以,c(Na+)>c(SO32﹣)+c(HSO3﹣),故B正确;
C、随pH增大,c(SO32﹣)增大,c(HSO3﹣)减小,所以 ![]() 的值减小,故C错误;
的值减小,故C错误;
D、随pH减小,α(HSO3﹣)减小,α(H2SO3)增大,故D正确;
故选C.
【考点精析】本题主要考查了弱电解质在水溶液中的电离平衡的相关知识点,需要掌握当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理才能正确解答此题.

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案【题目】苯甲酸甲酯是一种重要的工业原料,某研究性学习小组的同学拟用如图装置制取高纯度的苯甲酸甲酯. 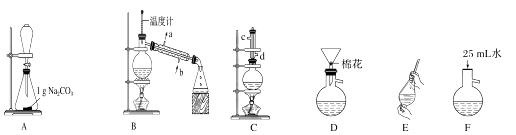
熔点/℃ | 沸点/℃ | 密度/gcm﹣3 | 水溶性 | |
苯甲酸 | 122.4 | 249 | 1.27 | 微溶 |
甲醇 | ﹣97 | 64.3 | 0.79 | 互溶 |
苯甲酸甲酯 | ﹣12.3 | 199.6 | 1.09 | 不溶 |
有关数据如表所示,请回答下列问题:
(1)在烧瓶中混合有机物及浓硫酸的方法是 , 装置C如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是 .
(2)B装置的冷凝管的主要作用是 , 可否换为球形冷凝管(填“可”或“否”).
(3)制备和提纯苯甲酸甲酯的操作先后顺序为(填装置字母代号).
(4)A中Na2CO3的作用是;D装置的作用是
(5)在洗涤、分液操作中,应充分振荡,然后静置,待分层后(填标号). a.直接将苯甲酸甲酯从分液漏斗的上口倒出
b.直接将苯甲酸甲酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将苯甲酸甲酯从下口放出
d.先将水层从分液漏斗的下口放出,再将苯甲酸甲酯从上口倒出.
