题目内容
20.氯吡格雷是一种血小板聚集抑制剂,以2-氯苯甲醛为原料合成该药物的路线如图:
根据以上信息,回答下列问题:
(1)分子C中除氯原子外的官能团名称为氨基、羧基,可用红外光谱(填物理方法)检测.
(2)X的结构简式为
 .
.(3)D→E的反应类型是取代反应.
(4)写出C在一定条件下生成一种含有3个六元环的产物的化学方程式
 .
.(5)同时满足下列两个条件的B的同分异构体共有9种(不包括B).
①与B含有相同的官能团②苯环上的取代基不超过2个
已知:
 =O$→_{H+}^{ROH}$
=O$→_{H+}^{ROH}$
乙醇为有机原料制备化合物
 ,需要经历的反应类型有①②③④(填写编号).①加成反应 ②消去反应 ③取代反应 ④氧化反应 ⑤还原反应.写出制备化合物
,需要经历的反应类型有①②③④(填写编号).①加成反应 ②消去反应 ③取代反应 ④氧化反应 ⑤还原反应.写出制备化合物  的最后一步反应的化学方程式
的最后一步反应的化学方程式 .
.
分析 (1)由结构简式可确定官能团,可用红外光谱检验;
(2)对比D、E的结构可知,D→E发生取代反应,由D、E的结构及X分子式确定X的结构;
(3)由D、E的结构可知,D→E发生取代反应;
(4)两分子C可在一定条件下反应生成一种产物,该产物分子中含有3个六元环,应是氨基与羧基之间发生脱水反应,两分子C脱去2分子水生成 ;
;
(5)B的同分异构体中,与B含有相同的官能团,苯环上的取代基不超过2个,则三个官能团可在同一个取代基,苯环有2个取代基,可有一个官能团与苯环直接相连,每种都有邻、间、对3种;
乙醇发生消去反应生成乙烯,乙烯与溴发生加成反应生成1,2-二溴乙烷,再发生水解反应生成乙二醇,甲醇催化氧化生成HCHO,最后乙二醇与甲醛反应生成 .
.
解答 解:(1)由结构简式可知分子C中除氯原子外的官能团还有氨基、羧基,可检测红外光谱,故答案为:氨基、羧基;红外光谱;
(2)由D、E的结构可知,D→E发生取代反应,由D、E的结构及X分子式,可知X的结构简式为: ,故答案为:
,故答案为: ;
;
(3)由D、E的结构可知,D→E发生取代反应,故答案为:取代;
(4)两分子C可在一定条件下反应生成一种产物,该产物分子中含有3个六元环,应是氨基与羧基之间发生脱水反应,两分子C脱去2分子水生成 ,该反应方程式为
,该反应方程式为 ,
,
故答案为: ;
;
(5)B的同分异构体中,与B含有相同的官能团,苯环上的取代基不超过2个,则三个官能团可在同一个取代基,苯环有2个取代基,可有一个官能团与苯环直接相连,每种都有邻、间、对3种,共10种,除B外还有9种,
故答案为:9;
乙醇发生消去反应生成乙烯,乙烯与溴发生加成反应生成1,2-二溴乙烷,再发生水解反应生成乙二醇,甲醇催化氧化生成HCHO,最后乙二醇与甲醛反应生成 ,涉及的反应类型有:消去反应、加成反应、氧化反应、取代反应,最后一步反应方程式为:
,涉及的反应类型有:消去反应、加成反应、氧化反应、取代反应,最后一步反应方程式为: ,
,
故答案为:①②③④; .
.
点评 本题考查有机物的推断与合成,为高频考点,侧重考查有机反应类型、同分异构体书写等,是对有机化学基础的综合考查,充分利用有机物的结构进行分析解答,较好的考查学生分析推理能力,难度中等.

| A. | 3种 | B. | 4种 | C. | 6种 | D. | 12种 |
(1)科学家发现NOx与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
I:2NO2(g)+NaCl(g)?NaNO3(g)+ClNO(g)△H1<0(平衡常数为K1)
II:ZNO(g)+Cl(g)?2ClNO(g)△H2<0(平衡常数为K2)
III:4NO2(g)+2NaCl(g)?2NaNO2(g)+2NO(g)+Cl2(g)△H3 (平衡常数为K3)
反应III中K3=$\frac{{K}_{1}^{2}}{{K}_{2}}$(用K1、K2表示),△H3=2△H1-△H2(用△H1、△H2表示).若反应 II在恒温、恒容条件下进行,能判断该反应一定达到平衡状态的标志是AD.
A.容器内混合气体的压强保持不变
B.v正(NO)=v逆(Cl2)
C.容器内混合气体的密度保持不变
D.容器内混合气体的平均相对分子质量保持不变
(2)汽车尾气中排放的NOx和CO会污染环境,在汽车尾气系统中安装催化转化器,可有效降低NOx和CO的排放,为了模拟应:2NO(g)+2CO(g)?N2(g)+2CO2(g)在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用传感器测得不同时间NO(g)和CO(g)的浓度如表:
| 时间/S | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/(10-4mol/L) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)/(10-3mol/L) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
此溫度下,该反应的平衡常数K=5000.
(3)科学家提出由CO2制取C的工艺如图1所示.已知:在重整系统中n(FeO):n(CO2)=5:1则在“热分解系统”中,FexOy的化学式为Fe5O7.

(4)NQx可“变废为宝”,由NO电解可制备NH4NO3,其工作原理如图2所示(M、N为多孔电极).为使电解产物全部转化为NH4NO3,需向电解产物中补充适量NH3.电解时M和电源负 极(填“正或负”)相连,书写N极发生的电极反应式.
实验Ⅰ:

(1)无色气体为NH3.
(2)该固体混合物的成分为NH4I、MgBr2、AlCl3.
实验Ⅱ:取一定量的该固体混合物溶于水配成1L溶液,并向该混合溶液中通入一定量的Cl2,测得溶液中几种阴离子(分别用A-、B-、C-表示)的物质的量与通入Cl2体积的关系如表所示.
| Cl2的体积 (标准状况下)/L | 2.8 | 5.6 | 11.2 |
| n(A-)/mol | 1.25 | 1.5 | 2 |
| n(B-)/mol | 1.5 | 1.4 | 0.9 |
| n(C-)/mol | a | 0 | 0 |
(4)原固体混合物中各组成成分的物质的量之比为.


 .
. .
. +
+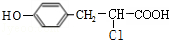 $→_{△}^{催化剂}$
$→_{△}^{催化剂}$ +HCl.
+HCl.
 ;写出化合物EDA的电子式
;写出化合物EDA的电子式 .
.