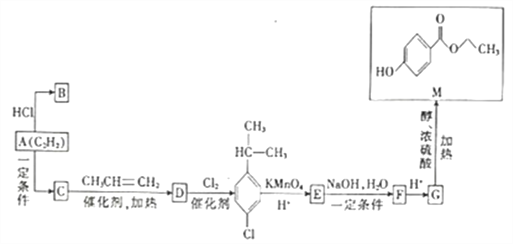
��Ŀ����
����Ŀ����ͼ��ʾ��װ���У���ͨ��ֱ����5 minʱ��ͭ�缫��������2.16 g��
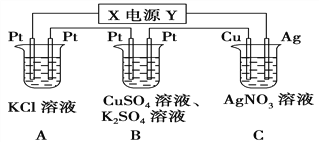
��1����Դ�缫X������Ϊ________��
��2��A�з��������ӷ���ʽΪ_______________________
��3��B�������ĵ缫��ӦʽΪ___________________________
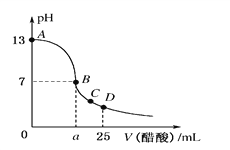
��4��pH�仯��A_______��B_______��C_______��(��������������С������������)
��5��ͨ��5 min��B�й��ռ�224 mL����(��״��)����Һ���Ϊ200 mL����ͨ��ǰCuSO4��Һ�����ʵ���Ũ��Ϊ______________(����ǰ����Һ����ޱ仯)��
��6����A��KCl��Һ�����Ҳ��200 mL��������Һ��pHΪ_______(����ǰ����Һ����ޱ仯)
���𰸡� ���� 2Cl-+2H2O![]() 2OH-+H2��+Cl2�� 4OH--4e-=O2��+2H2O ���� ��С ���� 0.025 mol��L��1 13
2OH-+H2��+Cl2�� 4OH--4e-=O2��+2H2O ���� ��С ���� 0.025 mol��L��1 13
�������������������ͼ����Ϣ��֪��A��B��C����װ�ô�����ͬһ��·�С�����ͭ�缫��������2.16 g�������ж�ͭ�缫Ϊ���������Դ��X�缫Ϊ������Y�缫Ϊ���������ԣ�A��B�ǵ�����C�ǵ��װ�á���·��ͨ���ĵ���Ϊn(e-)=n(Ag)= ![]() .
.
��1����Դ�缫X������Ϊ������
��2��A�з��������ӷ���ʽΪ2Cl-+2H2O![]() 2OH-+H2��+Cl2��.
2OH-+H2��+Cl2��.
��3��B�������ϣ���Һ��ˮ�����OH-���ӷŵ磬�缫��ӦʽΪ4OH--4e-=O2��+2H2O.
��4��A�е��������������أ���pH����B�е����������ᣬ��pH��С��C��һ�����װ�ã���pH���䡣
��5��ͨ��5 min��·��ͨ���ĵ���Ϊn(e-)=![]() ��B���������ռ���O2��n(O2)=
��B���������ռ���O2��n(O2)= ![]() ����ΪB�й��ռ�����״����224 mL���壨0.01mol��������B������һ������������0.005mol���ɴ˸��ݵ���ת���غ㣬����ȷ��B��һ������ͭ0.005mol��������Һ���Ϊ200 mL�����Լ����ͨ��ǰCuSO4��Һ�����ʵ���Ũ��Ϊ
����ΪB�й��ռ�����״����224 mL���壨0.01mol��������B������һ������������0.005mol���ɴ˸��ݵ���ת���غ㣬����ȷ��B��һ������ͭ0.005mol��������Һ���Ϊ200 mL�����Լ����ͨ��ǰCuSO4��Һ�����ʵ���Ũ��Ϊ![]() 0.025 mol��L��1��
0.025 mol��L��1��
��6����A��KCl��Һ�����Ҳ��200 mL��������Һ��n(OH-)=n(e-)=0.02mol����c(OH-)= ![]() ������pHΪ13��
������pHΪ13��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��ʵ��������һδ֪Ũ�ȵ�ϡ���ᣬijͬѧ��ʵ�����н���ʵ��ⶨ�����Ũ�ȡ������������գ�
��1������100mL0.100molL-1 NaOH����Һ��
�� ��Ҫ�������裺������������ܽ��_______����ȴ��ϴ�ӣ�����ϴ��Һ��������ƿ�������ݡ�ҡ�ȡ������ƺõ���Һ�����Լ�ƿ�У����ϱ�ǩ��
�� ����_____g�������ƹ������������У���ƽ�������롢���ӣ���________���ձ����������
��2��ȡ20.00 mL�������������ƿ�У����μ�23�η�̪��ָʾ���������Ƶı�NaOH��Һ���еζ����ظ������ζ�����23�Σ���¼�������£�
ʵ���� | NaOH��Һ��Ũ�ȣ�molL-1�� | ����NaOH��Һ�����(mL) | ������������(mL) |
1 | 0.100 | 22.18 | 20.00 |
2 | 0.100 | 22.22 | 20.00 |
3 | 0.100 | 22.20 | 20.00 |
�ٸ�ʵ��ζ��ﵽ�յ�ı�־��_____________________________��
�ڸ����������ݣ��ɼ�����������Ũ��ԼΪ_________________��������λ��Ч���֣���
��������ʵ���У����в���������������ȷ������ɲⶨ���ƫ�ߵ���_______________��
A.�ζ��յ����ʱ���Ӷ���
B����ʽ�ζ���ʹ��ǰ��ˮϴ��δ�ô���������ϴ
C����ƿˮϴ��δ����
D����ʽ�ζ��ܼ��첿�������ݣ��ζ�����ʧ
E������NaOH����ʱ����������KOH����
����������ʵ�����Ƶ�0.10 molL-1NaOH��Һ�ⶨʳ���������Ũ�ȣ�Ӧ��ѡ�õ�ָʾ��Ϊ_______��