题目内容
【题目】(1)某课外活动小组同学用图一装置进行实验,试回答下列问题:
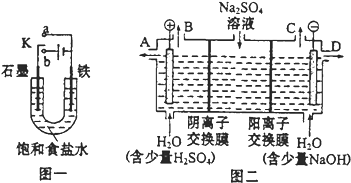
①若开始时开关K与a连接,则铁发生电化学腐蚀中的______腐蚀。
②若开始时开关K与b连接,则总反应的离子方程式为______。
(2)芒硝化学式为Na2SO410H2O,无色晶体,易溶于水,是一种分布很广泛的硫酸盐矿物。该小组同学设想,如果模拟工业上离子交换膜法制烧碱的方法,用图二所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念。
①该电解槽的阳极的电极反应式为_____。
②制得的氢氧化钠溶液从出口(填“A”、“B”、“C”或“D”)______导出。
③若将制得的氢气、氧气和氢氧化钠溶液组合为氢氧燃料电池,则电池正极的电极反应式为______。已知H2的燃烧热为285.8kJmol﹣1,则该燃料电池工作产生27g H2O(l)时,理论上有______ kJ的能量转化为电能。
【答案】 吸氧 2Cl﹣+ 2H2O![]() 2OH﹣+ H2↑ + Cl2↑ 4OH﹣- 4e﹣ = O2 + 2H2O D O2 + 4e﹣+ 2H2O = 4OH﹣ 428.7
2OH﹣+ H2↑ + Cl2↑ 4OH﹣- 4e﹣ = O2 + 2H2O D O2 + 4e﹣+ 2H2O = 4OH﹣ 428.7
【解析】本题主要考查原电池和电解池原理。
(1)①若开始时开关K与a连接,组成原电池,饱和食盐水是中性溶液,则铁发生电化学腐蚀中的吸氧腐蚀。
②若开始时开关K与b连接,组成电解池,电解饱和食盐水,则总反应的离子方程式为2Cl﹣+ 2H2O![]() 2OH﹣+ H2↑ + Cl2↑。
2OH﹣+ H2↑ + Cl2↑。
(2)①该电解槽的阳极的电极反应式为4OH﹣- 4e﹣ = O2 + 2H2O。
②右边是阴极区,氢氧化钠在阴极区生成,所以制得的氢氧化钠溶液从出口D导出。
③正极发生还原反应,电池正极的电极反应式为O2 + 4e﹣+ 2H2O = 4OH﹣。已知H2的燃烧热为285.8kJmol﹣1,则该燃料电池工作产生27g即1.5mol H2O(l)时,理论上有1.5×285.8kJ=428.7kJ的能量转化为电能。

 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案