��Ŀ����
����Ŀ����֪Cl - ��Ag + ��Ӧ����AgCl��ÿ�������ɵ�AgCl������10%����ֽ�ɵ������������������ֿ���ˮ��Һ��᪻���HClO 3 ��Ϊǿ�ᣩ��HCl�����������ɵ�Cl - ����ʣ���Ag + �������ɳ��������ѭ��������ֱ�����ա����к�1.1molNaCl����Һ�������м�������AgNO 3 �������������ɶ��ٿ������AgCl��Ag�����������Һ���Ϊ1L������Һ��H + ���ʵ���Ũ���Ƕ��٣�
���𰸡�167.94g 0.12mol/L
��������
�����������1��AgNO3+NaCl=NaNO3+AgCl��
��2��2AgCl![]() 2Ag+Cl2��
2Ag+Cl2��
��3��3Cl2+3H2O=5HCl+HClO3
��4��HCl+AgNO3=AgCl��+HNO3
�������ɵ�Ag�����ʵ���Ϊx���ɷֽ��ʿ�֪�����ɵ�AgClΪ9x�����ɷ�Ӧ�Ļ�ѧ����ʽ����ԭ���غ㣬������ԭ��ֻ������AgCl��HClO3�С����ԣ�9x+x/6��mol=1.1mol��n��Ag��=0.12mol��n��AgCl��=1.08mol���Ӷ��ó�m����=167��94 g��
c��H+��=0.12mol��1��L=0.12mol/L��

 ϰ�⾫ѡϵ�д�
ϰ�⾫ѡϵ�д�����Ŀ��ij�о�С��������ͼװ��̽���¶ȶ�CO��ԭFe2O3��Ӱ��(�̶�װ������
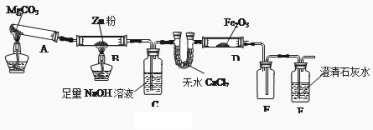
��1��MgCO3�ķֽ����Ϊ ��װ��B�еķ�Ӧ����ʽΪ ��
��2��װ��C�������� ������β���ķ���Ϊ ��
��3�����о�С���Ϊ���飬����ͼװ�ý��жԱ�ʵ�飬�����þƾ��ơ������þƾ���ƶ�װ��D���ȣ���Ӧ�����Ϊ��ɫ��ĩ(��������������ֱ��ò����������ʵ�顣
���� | ���� | �������� | �������� |
1 | ȡ��ɫ��ĩ����ϡ���� | �ܽ⣬������ | �ܽ⣬������ |
2 | ȡ����1����Һ���μ�K3[Fe(CN��6]��Һ | ��ɫ���� | ��ɫ���� |
3 | ȡ����1����Һ���μ�KSCN��Һ | ��� | ������ |
4 | ����3��Һ�еμ�������ˮ | ��ɫ��ȥ | �ȱ�죬����ɫ |
��֪��Fe2+��[Fe(CN��6]3-��Ӧ����Fe3[Fe(CN��6]2(��ɫ������
������õ��ĺ�ɫ��ĩ�� ��
�����鲽��1�з�Ӧ�����ӷ���ʽΪ ��
����ʵ�鰲ȫ���ǣ���ͼװ�û��ɲ�ȡ�ĸĽ���ʩ�� ��
�����鲽��4�У���Һ����ԭ��Ϊ ����Һ��ɫ���ܵ�ԭ���� ������֤����Ϊ ��
����Ŀ���������ʷ������ȷ�����( )
�� | �� | �� | ���������� | |
A | ���� | ���� | �ռ� | �������� |
B | �ռ� | ���� | ʳ�� | һ����̼ |
C | ������ | ���� | ʯ��ʯ | ˮ |
D | ���Լ� | ̼�� | �մ� | �������� |