题目内容
【题目】工业上常以铬铁矿(主要成分为亚铬酸亚铁FeCr2O4,还有Al2O3、SiO2等杂质)为主要原料生产红矾钠(Na2Cr2O7),某实验小组模拟其流程如下图所示:
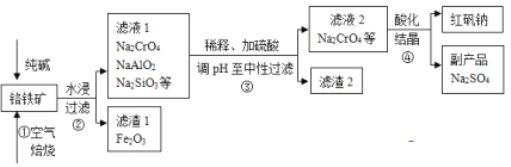
(1)步骤①中,焙烧时所用的仪器材质应选用_________(填“瓷质”、“铁质”或“石英质”),选用该材质的原因是(结合化学方程式解释): _____________________________________________。
(2)配平步骤①中主要反应:
____FeCr2O4+___O2+___Na2CO3![]() ___Fe2O3+___Na2CrO4+___CO2 _____________
___Fe2O3+___Na2CrO4+___CO2 _____________
(3)操作④中,酸化时,CrO42- (黄色)转化为Cr2O72-(橙色),写出平衡转化的离子方程式:____________________________________________________________。用红矾钠溶液进行下列实验:
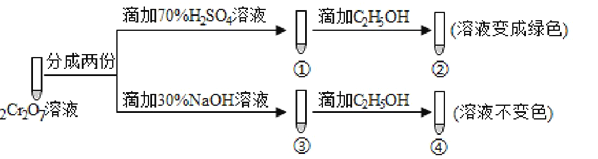
实验过程中,①中溶液橙色加深,③中溶液变黄,对比②和④可得出结论:___________________。
(4)步骤③用硫酸将溶液的pH调至中性,所得滤渣的主要成分是__________、____________;
(5)下图是Na2Cr2O7·2H2O和Na2SO4的溶解度曲线,步骤④中获得固态副产品Na2SO4的实验操作方法为____________、___________。

(6)某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴阳极,槽中盛放含铬废水,原理示意图如上,若不考虑气体的溶解,当收集到H213.44L(标准状况下)时有 ____________mol Cr2O72-被还原,一段时间后产生Fe(OH)3和Cr(OH)3沉淀。若电解后溶液中c(Cr3+)=3.0×10-5mol·L-1,则c(Fe3+)=_________。(已知Ksp[Fe(OH)3]=4.0×10-38mol·L-1,Ksp[Cr(OH)3]=6.0×10-31mol·L-1)
【答案】铁质 Na2CO3+SiO2![]() Na2SiO3+CO2↑ 4 7 8 2 8 8 2CrO42-+2H+Cr2O72-+H2O 红矾钠酸性溶液 氧化性强 H2SiO3(H4SiO4或SiO2·H2O) Al(OH)3 加热浓缩 趁热过滤 0.1 mol 2.0×10-12mol·L-1
Na2SiO3+CO2↑ 4 7 8 2 8 8 2CrO42-+2H+Cr2O72-+H2O 红矾钠酸性溶液 氧化性强 H2SiO3(H4SiO4或SiO2·H2O) Al(OH)3 加热浓缩 趁热过滤 0.1 mol 2.0×10-12mol·L-1
【解析】
(1)焙烧时,加入纯碱,Na2CO3在高温下与SiO2发生反应,瓷质、石英成分是SiO2,因此焙烧时应选用铁质,SiO2与Na2CO3反应的方程式为Na2CO3+SiO2![]() Na2SiO3+CO2;
Na2SiO3+CO2;
(2)FeCr2O4中Fe显+2价,Cr显+3价,根据反应方程式为,Fe元素的化合价由+2价→+3价,升高1价,Cr元素的化合价由+3价→+6价,Cr整体升高6价,FeCr2O4整体升高7价,O2中O的化合价降低,整体降低4价,最小公倍数为28,根据原子守恒配平其他,反应方程式为4FeCr2O4+7O2+8Na2CO3=2Fe2O3+8Na2CrO4+8CO2;
(3)CrO42-溶液中存在:2CrO42-+2H+![]() Cr2O72-+H2O,酸化,加入H+,c(H+)增大,平衡向正反应方向进行,溶液颜色由黄色转化为橙色;①:加入硫酸,促使平衡向正反应方向进行,①中滴加C2H5OH,溶液变成绿色,Cr元素以Cr3+形式存在,发生氧化还原反应;红钒钠溶液中加入NaOH,使平衡向逆反应方向进行,滴加C2H5OH溶液,溶液不变色,没有发生氧化还原反应,对比实验得出结论是红钒钠在酸性条件下具有强氧化性;
Cr2O72-+H2O,酸化,加入H+,c(H+)增大,平衡向正反应方向进行,溶液颜色由黄色转化为橙色;①:加入硫酸,促使平衡向正反应方向进行,①中滴加C2H5OH,溶液变成绿色,Cr元素以Cr3+形式存在,发生氧化还原反应;红钒钠溶液中加入NaOH,使平衡向逆反应方向进行,滴加C2H5OH溶液,溶液不变色,没有发生氧化还原反应,对比实验得出结论是红钒钠在酸性条件下具有强氧化性;
(4)根据流程图,反应③除去Al、Si等元素,银此滤液1中加入硫酸发生AlO2-+H++H2O=Al(OH)3↓,SiO32-+2H+=H2SiO3↓,滤渣成分是H2SiO3和Al(OH)3;
(5)得到Na2SO4,根据图像,Na2SO4的溶解度随着温度的升高而降低,得到Na2SO4的操作方法是蒸发浓缩、冷却结晶;
(6)根据装置图,B电极反应式为2H++2e-=H2↑,A电极反应式为Fe-2e-=Fe2+,建立:H2~Fe2+,n(Fe2+)=13.44/22.4mol=0.6mol,根据得失电子数目守恒,n(Fe2+)×1=n(Cr2O72-)×2×3,解得n(Cr2O72-)=0.1mol,同时产生Fe(OH)3和Cr(OH)3沉淀,则溶液中有c(Fe3+)/c(Cr3+)=Ksp[Fe(OH)3]/Ksp[Cr(OH)3],代入数值,得出:c(Fe3+)=2.0×10-12mol·L-1。

【题目】下列三个化学反应的平衡常数(K1、K2、K3)与温度的关系分别如下表所示:
化学反应 | 平衡常数 | 温度 | |
973K | 1173K | ||
①Fe(s)+CO2(g) | K1 | 1.47 | 2.15 |
②Fe(s)+H2O(g) | K2 | 2.38 | 1.67 |
③CO(g)+H2O(g) | K3 | ? | ? |
则下列说法正确的是
A.△H1<0,△H2>0
B.反应①②③的反应热满足关系:△H2-△H1=△H3
C.反应①②③的平衡常数满足关系:K1·K2=K3
D.要使反应③在一定条件下建立的平衡向正反应方向移动,可采取升温措施