题目内容
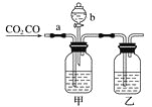
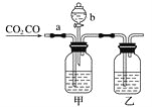
【题目】用如图所示装置进行下列实验,将①中溶液滴入②中,预测的现象与实际相符的是

选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A | 浓硫酸 | 用砂纸打磨过的铁片 | 产生大量气泡 |
B | AgNO3溶液 | 浓氨水 | 产生白色沉淀且不消失 |
C | NH4Cl浓溶液 | Fe、C混合物 | 溶液中有气泡产生 |
D | H2O2溶液 | FeCl3溶液 | 溶液逐渐褪色 |
A. AB. BC. CD. D
【答案】C
【解析】
A项、常温下,铁在浓硫酸中发生钝化,不能观察到产生大量气泡,现象不合理,故A错误;
B项、AgNO3溶液滴入浓氨水中,浓氨水过量,与AgNO3溶液反应生成银氨络离子,没有沉淀生成,故B错误;
C项、氯化铵在溶液中水解,使溶液呈酸性,Fe、C混合物在NH4Cl浓溶液中构成原电池,铁溶解,由氢气生成,故C正确;
D项、FeCl3可以做H2O2溶液发生分解反应的催化剂,不会出现溶液逐渐褪色,故D错误;
故选C。

 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案【题目】I.下表是不同温度下水的离子积数据:
温度/℃ | 25 | t1 | t2 |
水的离子积KW | 1×10-14 | 1×10-13 | 1×10-12 |
试回答以下问题:
(1)25℃下,某Na2SO4溶液中c(SO42-)=5×10-4 molL-1,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)=____________。
(2)在t2℃下,将a molL-1CH3COOH溶液与b molL-1NaOH溶液等体积混合反应后,溶液恰好呈中性,则该温度下CH3COOH的电离常数Ka=____________(用a、b表示)。
II.已知:25℃下,下列反应:①Ag+(aq)+2NH3(aq)![]() Ag(NH3)2+(aq) △H=a kJmol-1 K=c;
Ag(NH3)2+(aq) △H=a kJmol-1 K=c;
②2Ag+(aq)+2OH-(aq)![]() Ag2O(s)+H2O(l) △H=b kJmol-1 K=d
Ag2O(s)+H2O(l) △H=b kJmol-1 K=d
(3)写出Ag2O溶于氨水(用NH3表示)生成银氨溶液[Ag(NH3)2+]的热化学方程式:_____________;计算25℃下,该反应的平衡常数(用c、d表示)K=____________________。
III.某镁盐溶液中含有杂质离子Cr3+,所含主要离子及其浓度如下表所示(H+和OH-未列出):
离子 | Mg2+ | Cr3+ | Cl- |
浓度(mol/L) | 0.5 | 0.01 | a |
已知 25℃时,Ksp[Cr(OH)3]=10-32;Ksp[Mg (OH)2]=5×10-11;操作过程中溶液体积的变化忽略不计。
(4)表格中的a____________1.03(填“<”、“>”或“=”)。
(5)除去杂质Cr3+离,可加入MgO调节溶液pH,理论上应调节pH的范围是_______________。
(6)溶液经除杂、过滤后,由滤液制取氯化镁晶体(MgCl26H2O)的操作是___________________。