题目内容
实验是研究化学的基础,下图所示的实验方法、装置或操作完全正确的是
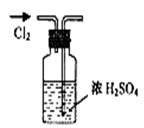
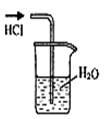
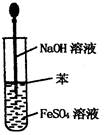
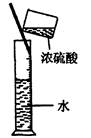




| A.干燥Cl2 | B.吸收NH3 | C.制取Fe(OH)2沉淀 | D.稀释浓H2SO4 |
C
略

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
题目内容




| A.干燥Cl2 | B.吸收NH3 | C.制取Fe(OH)2沉淀 | D.稀释浓H2SO4 |

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案