��Ŀ����
����Ŀ�������������壨FeSO47H2O����ҽҩ������Ѫ����ij�����о�С��ⶨ�ò�Ѫ������Ԫ�صĺ�����ʵ�鲽�����£� 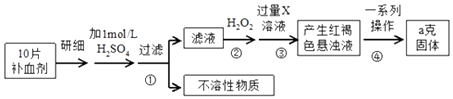
��ش��������⣺
��1��֤���������Һ�к���Fe2+�ķ������ȵμ�KSCN��Һ���ٵμ� �� �ù��̵�����Ϊ�� ��
��2������ڼ������H2O2��Ŀ�ģ� ��
��3��������з�Ӧ�����ӷ���ʽ�� ��
��4����ʵ������ģ���ÿƬ��Ѫ������Ԫ�ص�����g��
��5����С����Щͬѧ��Ϊ��KMnO4��Һ�ζ�Ҳ�ܽ�����Ԫ�غ����IJⶨ��
��5Fe2++MnO4��+8H+=5Fe3++Mn2++4H2O��
��ʵ��ǰ������Ҫ��ȷ����һ�����ʵ���Ũ�ȵ�KMnO4��Һ250mL������ʱ��Ҫ����������ƽ���������ձ�����ͷ�ι��⣬���� ��
������ʵ���е�KMnO4��Һ��Ҫ�ữ�������ữ������ ��
a��ϡ���� b��ϡ���� c��ϡ���� d��Ũ����
�۵ζ����յ�ʱ����ɫΪɫ�����ζ����յ�ʱ���ӵζ��̶ܿ��ߣ��Բ���ֵ�к�Ӱ�죿�� �ƫ�ߡ�ƫ�ͻ���Ӱ�족����
���𰸡�
��1����ˮ����˫��ˮ��ϡ���ᣩ����Һ��ʼ����ɫ�����ΪѪ��ɫ
��2����Fe2+ȫ������ΪFe3+
��3��Fe3++3NH3?H2O�TFe��OH��3��+3NH4+
��4��0.07a
��5��250mL����ƿ��b���ϻ��Ϻ죻ƫ��
���������⣺��1��Fe3+��KSCN��Һ�Ժ�ɫ�����������ڼ���Fe3+���ڣ����Լ�����������Fe2+����ΪFe3+����Fe2+ �� �����ȵμ�KSCN��Һ����Һ����ɫ��������ˮ����˫��ˮ��ϡ���ᣩ������2Fe2++Cl2�T2Fe3++2Cl�� �� ��Һ��ΪѪ��ɫ������Fe3++3SCN��Fe��SCN��3 �� ˵������Fe2+ ��
���Դ��ǣ���ˮ����˫��ˮ��ϡ���ᣩ����Һ��ʼ����ɫ�����ΪѪ��ɫ����2��˫��ˮ���������ԣ������������ܽ�Fe2+ȫ������ΪFe3+ �� 2H++H2O2+2Fe2+=2Fe3++2H2O�����Դ��ǣ���Fe2+ȫ������ΪFe3+����3��������ǽ�Fe3+ת��Ϊ�����������������Լ��백ˮ����Ӧ���ӷ���ʽΪFe3++3NH3H2O�TFe��OH��3��+3NH4+ ��
���Դ��ǣ�Fe3++3NH3H2O�TFe��OH��3��+3NH4+����4��ag����������Ԫ�ص�������Ϊ10Ƭ��Ѫ������������������ÿƬ��Ѫ������Ԫ�ص����� ![]() =0.07ag�����Դ��ǣ�0.07a����5���پ�ȷ����һ�����ʵ���Ũ�ȵ�KMnO4��Һ250mL������ʱ��Ҫ����������ƽ��ҩ�ס��������ձ�����ͷ�ιܡ�250mL����ƿ�����Դ��ǣ�250mL����ƿ��
=0.07ag�����Դ��ǣ�0.07a����5���پ�ȷ����һ�����ʵ���Ũ�ȵ�KMnO4��Һ250mL������ʱ��Ҫ����������ƽ��ҩ�ס��������ձ�����ͷ�ιܡ�250mL����ƿ�����Դ��ǣ�250mL����ƿ��
�ڸ��������ǿ�����ԣ��ܽ�����������������������ԣ�������������������ֻ����ϡ�����ữ�����Դ��ǣ�b��
���ø��������Һ�ζ���������ʱ���ζ����յ�ʱ��Һ�������ɫ���Ϻ�ɫ�����ζ����յ�ʱ���ӵζ��̶ܿ��ߣ�������ĸ��������Һ�����ƫС�����Ի�ʹ����ֵƫ�ͣ�
���Դ��ǣ��ϻ��Ϻ죻ƫ�ͣ�

 ����Ӣ��ϵ�д�
����Ӣ��ϵ�д� ����ѧУ�ֲ����ܲ�ϵ�д�
����ѧУ�ֲ����ܲ�ϵ�д� �ƸԺ���ȫ�����Ų��Ծ�ϵ�д�
�ƸԺ���ȫ�����Ų��Ծ�ϵ�д�