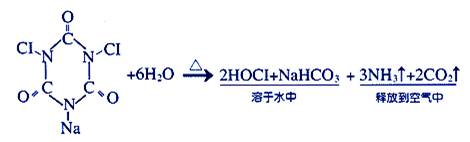
题目内容
将一定量的氯气通入250 mL溴化钾溶液中,然后将所得的溶液蒸干,并将残渣灼烧,得到干燥的残渣40 g,分析残渣,其中含25%的化合态的溴,试计算:
(1)通入的一定量的氯气是多少克?(氯气无剩余)
(2)原溴化钾溶液含KBr多少克?
(1)通入的一定量的氯气是多少克?(氯气无剩余)
(2)原溴化钾溶液含KBr多少克?
(1)11.97 g (2)55.01 g
溴化钾溶液中通入氯气,必然会产生氯化钾和溴,由已知25%的化合态的溴可设法求出溴化钾的质量,从而求出40 g残渣中氯化钾的质量,再根据化学反应方程式将氯化钾当成已知量以求算通入的氯气是多少克,并求原溶液中的溴化钾为多少克。搞清残渣成分和正确换算是关键。
40 g残渣中所含Br-的质量为:40 g×25%="10" g。求KBr的质量:由Br—KBr的质量比:80∶119得KBr的质量=10×119÷80="14.87" g。设x g Cl2与y g KBr反应生成了25.13 g KCl,则
Cl2+2KBr====2KCl+Br2
71 238 149
x y 25.13
x=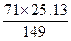 ="11.97" g
="11.97" g
y=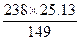 ="40.14" g
="40.14" g
在250 mL溴化钾溶液中共含KBr的质量:
40.14 g+14.87 g="55.01" g。
40 g残渣中所含Br-的质量为:40 g×25%="10" g。求KBr的质量:由Br—KBr的质量比:80∶119得KBr的质量=10×119÷80="14.87" g。设x g Cl2与y g KBr反应生成了25.13 g KCl,则
Cl2+2KBr====2KCl+Br2
71 238 149
x y 25.13
x=
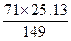 ="11.97" g
="11.97" gy=
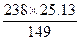 ="40.14" g
="40.14" g在250 mL溴化钾溶液中共含KBr的质量:
40.14 g+14.87 g="55.01" g。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 绿色溶液
绿色溶液 A
A Cl2 加入
Cl2 加入 NaOH溶液△
NaOH溶液△ 黑色固体E
黑色固体E