题目内容
【题目】利用化学反应原理研究碳、硫及其化合物的性质具有重要意义。
(1)工业上用炭还原辉铜矿(主要成分是Cu2S),可制取金属铜。
已知反应的热化学方程式如下:
C(s)+S2 (g) ═CS2 (g) △H1=150 KJ/mol
Cu2S(s)+H2 (g) ═2Cu(s)+H2S (g) △H2=59.5KJ/mol
2H2S (g) ═2H2 (g) +S2 (g) △H3=170KJ/mol
通过计算,可知用炭还原Cu2S 制取金属铜和CS2(g) 的热化学方程式为___________。
(2)为研究反应2H2S(g)![]() 2H2(g)+S2(g)对上述工业过程的影响,兴趣小组进行如下探究:
2H2(g)+S2(g)对上述工业过程的影响,兴趣小组进行如下探究:
①向三个体积均为1L的恒容密闭容器中分别加入1molH2S,进行H2S分解实验。不同温度下测得H2S 的转化率与时间的关系如图1所示:
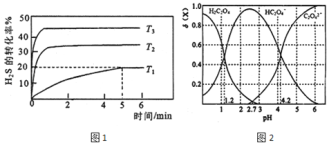
T1温度下,0~5min S2(g)的平均反应速率v(S2)=____________mol.L-1.min-1,反应平衡常数K=_____molL-1.温度T1、T2、T3 由高到低的顺序是__________。
②T4温度时,向1L的恒容密闭容器中加入1.8molH2(g)、1.2molS2(g),达到平衡后测得S2(g)和H2S(g)的浓度相等,则T4_____ T1 (填“<”、“=”或“>”)。
(3)T℃时,向某浓度的草酸溶液中逐滴加入一定浓度的NaOH 溶液,所得溶液中三种微粒H2C2O4、HC2O4-、C2O42- 的物质的量分数(δ) 与pH的关系如图2所示:
①草酸的电离常数分别为K1与K2,则![]() =_____。
=_____。
②按投料比n(Na2C2O4):n(NaHC2O4)=2:1配成溶液,下列有关该溶液的叙述正确的是_____(填序号)。
A.该溶液的pH为4.2
B.3c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-)
C.3c(Na+)=5[c(HC2O4-)+c(C2O42-)+c(H2C2O4)]
D.3c(OH-)+c(C2O42-)=3c(H+)+2c(HC2O4-)+5c(H2C2O4)
(4)含碳的甲醇(CH3OH)的废水随意排放会造成水污染,可用ClO2将其氧化为CO2,然后再加碱中和即可。
①写出处理甲醇酸性废水过程中,ClO2与甲醇反应的离子方程式:___________________。
②常温下,向100 mL0.1mol/L的NaOH溶液中通入一定量的CO2。为探究反应后混合溶液的成分,向其中逐滴加入0.1 mol/L的HCl溶液。溶液产生气体前,消耗V( HCl)=V1;溶液刚好不再产生气体时,消耗V( HCl) =V2。当V1 <V2 <2Vl时,混合溶液中溶质的成分为________
【答案】C(s)+2Cu2S(s)=4Cu(s)+CS2(g)△H=439KJmol-l 0.02 6.25×10-3 T3>T2>T1 > 103 CD 5CH3OH+6ClO2=6Cl-+5CO2+6H++7H2O NaOH、Na2CO3
【解析】
(1) ①C(s)+S2 (g) ═CS2 (g) △H1=150 kJ/mol
②Cu2S(s)+H2 (g) ═2Cu(s)+H2S (g) △H2=59.5 kJ/mol
③2H2S (g) ═2H2 (g) +S2 (g) △H3=170 kJ/mol
由①+②![]() 2+③可得:C(s)+2 Cu2S(s)=4 Cu(s)+ CS2 (g) 的△H;
2+③可得:C(s)+2 Cu2S(s)=4 Cu(s)+ CS2 (g) 的△H;
(2) T1温度下,0~5min S2(g)的平均反应速率v(S2)=![]() ,据此计算回答;根据三行式计算平衡常数;反应是吸热反应,温度越高,反应物的转化率越大;
,据此计算回答;根据三行式计算平衡常数;反应是吸热反应,温度越高,反应物的转化率越大;
(3)①平衡常数随温度变化,不随浓度变化,图象中根据(1.2,0.5)可计算出K1,根据(4.2,0.5)可计算出K2,据此回答;
②按投料比n(Na2C2O4):n(NaHC2O4)=2:1配成溶液,存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-),存在物料守恒:3c(Na+)=5[c(HC2O4-)+c(C2O42-)+c(H2C2O4)],根据图中信息来回答即可。
(4)①根据信息:二氧化氯和甲醇反应,生成Cl-、CO2和水,根据电子得失守恒写出离子方程式;
②按照混合溶液中可能成分的几种情况,逐滴加入盐酸,根据依次发生的反应,看对应盐酸所用体积是否为V1 <V2 <2Vl,来确定溶质的成分。
(1) ①C(s)+S2 (g) ═CS2 (g) △H1=150 kJ/mol
②Cu2S(s)+H2 (g) ═2Cu(s)+H2S (g) △H2=59.5 kJ/mol
③2H2S (g) ═2H2 (g) +S2 (g) △H3=170 kJ/mol
由①+②![]() 2+③可得:C(s)+2 Cu2S(s)=4 Cu(s)+ CS2 (g) 的△H=150 kJ/mol+(59.5 kJ/mol)
2+③可得:C(s)+2 Cu2S(s)=4 Cu(s)+ CS2 (g) 的△H=150 kJ/mol+(59.5 kJ/mol)![]() 2+170 kJ/mol=439 kJ/mol,
2+170 kJ/mol=439 kJ/mol,
因此,本题正确答案是:C(s)+2 Cu2S(s)=4 Cu(s)+ CS2 (g) △H=439KJmol-l ;
(2)① 2H2S(g)![]() 2H2(g)+S2(g),
2H2(g)+S2(g),
起始浓度(mol/L) 1 0 0
变化浓度(mol/L) 0.2 0.2 0.1
平衡浓度(mol/L) 0.8 0.2 0.1
T1温度下,0~5min S2(g)的平均反应速率
v(S2)==![]() =
=![]() =0.02 mol.L-1.min-1,
=0.02 mol.L-1.min-1,
反应平衡常数K=![]() =
=![]() =6.25
=6.25![]() 10-3,反应是吸热反应,温度越高,反应物的转化率越大,所以温度T1、T2、T3由高到低的顺序是T1、T2、T3;
10-3,反应是吸热反应,温度越高,反应物的转化率越大,所以温度T1、T2、T3由高到低的顺序是T1、T2、T3;
因此,本题正确答案是:0.02 ;6.25×10-3 ;T3>T2>T1;
②T4温度时,向1L的恒容密闭容器中加入1.8molH2(g)、1.2molS2(g),达到平衡后测得S2(g)和H2S(g)的浓度相等,说明反应正向进行,所以T4高于T1。
因此,本题正确答案是:>;
(3)①坐标(1.2,0.5)时H2C2O4和HC2O4-的含量相同,则K1=c(H+)=10-1.2,坐标(4.2,0.5)时HC2O4-和C2O42-的浓度相等,K2=c(H+)=10-4..2,则![]() =
=![]() =1000,
=1000,
因此,本题正确答案是:103;
②A、按投料比n(Na2C2O4):n(NaHC2O4)=2:1配成溶液,此时三种微粒H2C2O4、HC2O4-、C2O42-的物质的量分数不是0.5,所以该溶液的pH不是4.2,故A错误;
B、按投料比n(Na2C2O4):n(NaHC2O4)=2:1配成溶液,存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-),故B错误;
C、n(Na2C2O4):n(NaHC2O4)=2:1的溶液中存在物料守恒:3c(Na+)=5[c(HC2O4-)+c(C2O42-)+c(H2C2O4)],所以C选项是正确的;
D. 3c(Na+)=5[c(HC2O4-)+c(C2O42-)+c(H2C2O4)],的溶液中存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-),存在物料守恒:3c(Na+)=5[c(HC2O4-)+c(C2O42-)+c(H2C2O4)],整理得到:3c(OH-)+c(C2O42-)=3c(H+)+2c(HC2O4-)+5c(H2C2O4),所以D选项是正确的。
因此,本题正确答案是:CD;
(4)①根据信息:二氧化氯和甲醇反应,生成Cl-、CO2和水,所以反应方程式为:6ClO2+5CH3OH=6Cl-+5CO2+6H++7H2O,
因此,本题正确答案是:6ClO2+5CH3OH=6Cl-+5CO2+6H++7H2O;
②若混合溶液中成分为NaOH、Na2CO3时,逐滴加入盐酸,依次发生反应:H++OH-=H2O、CO32-+H+=HCO3-,HCO3-+H+=H2O+CO2↑,假设NaOH有amol,Na2CO3有bmol,则刚产生气体时,消耗盐酸的物质的量为(a+b)mol,溶液中不再产生气体时,消耗的盐酸的物质的量为(a+2b)mol,因为a+b<a+2b<2(a+b),则对应盐酸所用体积为V1 <V2 <2Vl,故混合溶液中溶质的成分为NaOH、Na2CO3;
若混合溶液中成分为NaOH、NaHCO3时,溶液不能大量共存,故不可能;
若混合溶液中成分为NaHCO3、Na2CO3时,逐滴加入盐酸,依次发生反应:CO32-+H+=HCO3-、HCO3-+H+=H2O+CO2↑,假设NaHCO3有amol,Na2CO3有bmol,则刚产生气体时,消耗盐酸的物质的量为bmol,溶液中不再产生气体时,消耗的盐酸的物质的量为(a+2b)mol,对应的溶液体积为V2 >2Vl,,故不符合题意;
综上所述,本题正确答案为NaOH、Na2CO3。
因此,本题正确答案是:NaOH、Na2CO3。

 小学期末标准试卷系列答案
小学期末标准试卷系列答案