题目内容
取一定量的NaOH溶液通入CO2后,再继续向该溶液中逐滴加入0.1 mol/L的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系如图所示,下列有关说法正确的是( )
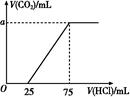

| A.原溶液中NaOH的物质的量为0.75 mol |
| B.通入CO2后所得的溶液溶质成分为NaOH和Na2CO3 |
| C.通入CO2后所得的溶液中含有2.5×10-3 mol NaHCO3 |
| D.纵坐标中a的数值为224 |
C
由于盐酸逐滴滴入到碳酸盐中的反应为:Na2CO3+HCl NaHCO3+NaCl;NaHCO3+HCl
NaHCO3+NaCl;NaHCO3+HCl NaCl+CO2↑+H2O,从图像中分析可以发现0~25 mL段消耗的酸体积小于生成气体的体积段消耗酸的体积,所以可以得到溶质的成分是NaHCO3和Na2CO3的混合物,且根据0~25 mL段消耗酸的体积可以判断出Na2CO3的物质的量为2.5×10-3 mol,由25~75 mL段知消耗酸25 mL时,NaHCO3总共(75-25)×10-4 mol=5×10-3 mol,其中由Na2CO3转化过来的NaHCO3是:2.5×10-3 mol,则通入CO2后所得溶液中NaHCO3为:5×10-3 mol-2.5×10-3 mol=2.5×10-3 mol,C正确;其中纵坐标a的数值为112。
NaCl+CO2↑+H2O,从图像中分析可以发现0~25 mL段消耗的酸体积小于生成气体的体积段消耗酸的体积,所以可以得到溶质的成分是NaHCO3和Na2CO3的混合物,且根据0~25 mL段消耗酸的体积可以判断出Na2CO3的物质的量为2.5×10-3 mol,由25~75 mL段知消耗酸25 mL时,NaHCO3总共(75-25)×10-4 mol=5×10-3 mol,其中由Na2CO3转化过来的NaHCO3是:2.5×10-3 mol,则通入CO2后所得溶液中NaHCO3为:5×10-3 mol-2.5×10-3 mol=2.5×10-3 mol,C正确;其中纵坐标a的数值为112。
 NaHCO3+NaCl;NaHCO3+HCl
NaHCO3+NaCl;NaHCO3+HCl NaCl+CO2↑+H2O,从图像中分析可以发现0~25 mL段消耗的酸体积小于生成气体的体积段消耗酸的体积,所以可以得到溶质的成分是NaHCO3和Na2CO3的混合物,且根据0~25 mL段消耗酸的体积可以判断出Na2CO3的物质的量为2.5×10-3 mol,由25~75 mL段知消耗酸25 mL时,NaHCO3总共(75-25)×10-4 mol=5×10-3 mol,其中由Na2CO3转化过来的NaHCO3是:2.5×10-3 mol,则通入CO2后所得溶液中NaHCO3为:5×10-3 mol-2.5×10-3 mol=2.5×10-3 mol,C正确;其中纵坐标a的数值为112。
NaCl+CO2↑+H2O,从图像中分析可以发现0~25 mL段消耗的酸体积小于生成气体的体积段消耗酸的体积,所以可以得到溶质的成分是NaHCO3和Na2CO3的混合物,且根据0~25 mL段消耗酸的体积可以判断出Na2CO3的物质的量为2.5×10-3 mol,由25~75 mL段知消耗酸25 mL时,NaHCO3总共(75-25)×10-4 mol=5×10-3 mol,其中由Na2CO3转化过来的NaHCO3是:2.5×10-3 mol,则通入CO2后所得溶液中NaHCO3为:5×10-3 mol-2.5×10-3 mol=2.5×10-3 mol,C正确;其中纵坐标a的数值为112。
练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
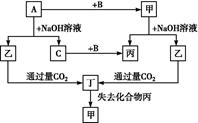
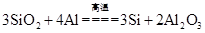
 CaSiO3+CO2↑
CaSiO3+CO2↑