题目内容
【题目】下列物质久置于空气中会发生相应的变化,其中发生了氧化还原反应的是( )
A. 敞口浓硫酸变重B. 敞口浓盐酸变稀
C. 裸露的铝片表面失去光泽D. 氢氧化钠的表面变潮湿
【答案】C
【解析】
根据发生的变化,分析存在的化学反应,如反应中存在元素的化合价变化,则发生了氧化还原反应,以此来解答。
A.浓硫酸的体积增大,吸收空气中的水,没有发生化学变化,故A不选;
B. 敞口浓盐酸,因溶质氯化氢挥发而使溶液变稀,没有发生化学变化,故B不选;
C. 裸露的铝片表面失去光泽,发生Al与氧气的化合反应,Al、O元素的化合价变化,发生了氧化还原反应,故C选;
D. 氢氧化钠潮解为物理变化,不发生化学变化,故D不选。
答案选C。

 53随堂测系列答案
53随堂测系列答案【题目】关于下列材料说法不正确是( )
序号 | 材料 | 类别 | 性能 | 用途 |
A | 钛合金 | 金属材料 | 密度小,强度高 | 制飞机机翼 |
B | 普通玻璃 | 硅酸盐材料 | 熔点高,透明 | 制试管、烧杯 |
C | 压电陶瓷 | 半导体材料 | 具有压电效应 | 声纳、地震仪 |
D | 氮化硅陶瓷 | 新型无机非金属材料 | 硬度高,耐磨 | 制发动机 |
A. AB. BC. CD. D
【题目】某研究小组利用软锰矿浆(主费成分是MnO2)吸收工业要气中的SO2,并制备硫酸锰的生产流程如下(浸出液的pH<2,其中除含Mn2+外。还含有少量Fe2+、Al3+、Ca2+等金属离子):
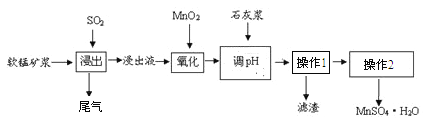
操作1的滤液通过阳离子吸附剂除去Ca2+。金属离子形成氢氧化物沉淀时的pH见下表:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe2+ | 7.6 | 9.7 |
Fe3+ | 2.7 | 3.7 |
Al3+ | 3.8 | 4.7 |
Mn2+ | 8.3 | 9.8 |
请回答下列问题:
(1)浸出过程中被氧化的物质的化学式为____________________________。
(2)氧化过程中主要反应的离子方程式_________________________________。
(3)在氧化后的液体中加入石灰浆调节pH,pH的范围是_____________________。
(4)操作1的名称是________,操作2包括蒸发浓缩、______过滤、洗涤、干燥等操作。
(5)为测定所得MnSO4·H2O的纯度,准确称取上述样品1.720g加入适量H2SO4和NH4NO3溶液,加热使Mn2+全部氧化成Mn3+后,配成200mL溶液。取20.00mL该溶液,向其中逐滴加入0.0500mol/L的FeSO4溶液,发生如下反应:Fe2++Mn3+=Fe3++Mn2+。当反应恰好完全进行时,共消耗FeSO4溶液19.50mL。通过计算确定MnSO4·H2O的纯度(写出计算过程)_____。