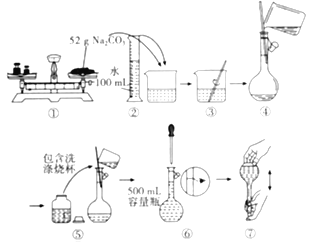
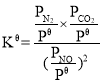题目内容
【题目】下列叙述正确的是( )
A.胶体的本质特征是丁达尔效应
B.焰色反应是元素的性质,属于化学变化
C.密度为1.84g/ml、98%的硫酸,其物质的量浓度为1.84mol/L
D.NA个HCl分子的质量(以克为单位)与其相对分子质量在数值上相等
【答案】D
【解析】
A. 胶体的本质特征是胶粒直径介于10-9~10-7m之间,A不合题意;
B. 焰色反应是元素的离子核外电子由稳定态吸收能量转化为不稳定态,再由不稳定态释放能量转化为稳定态的过程,能量以光的形式释放,所以我们看到焰色,属于物理变化,B不合题意;
C. 密度为1.84g/ml、98%的硫酸,其物质的量浓度为![]() =18.4mol/L,C不正确;
=18.4mol/L,C不正确;
D. NA个HCl分子的质量(以克为单位),数值上等于HCl的摩尔质量,与其相对分子质量在数值上相等,D正确。
故选D。

练习册系列答案
相关题目