题目内容
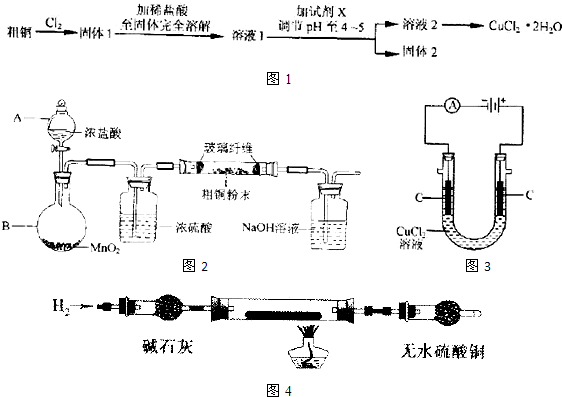
(14分)氯化铜晶体(CuCl2·xH2O)是重要的化工原料,可用作催化剂、消毒剂等。用孔雀石[主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物]制备氯化铜晶体,方案如下:
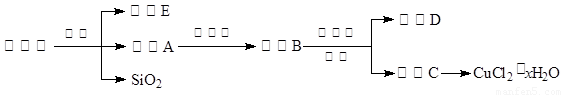
已知:有关金属离子从开始沉淀到沉淀完全时溶液的pH:
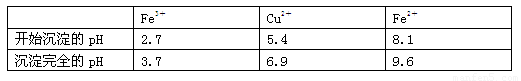
⑴酸溶时,为了提高浸取率可采取的措施有 。(写出一点)
⑵若溶液A含有的金属离子有Cu2+、Fe2+,则试剂①为Cl2,通入Cl2发生反应的离子方程式: 。
⑶加入试剂②的目的是调节pH至a,a的范围是 ;
为避免引入杂质离子,试剂②可选用 。
A.氨水 B.氧化铜 C.氢氧化铜 D.氢氧化钠
⑷由溶液C获得CuCl2·xH2O,实验操作依次是加热浓缩、冷却结晶、过滤和洗涤等操作。加热浓缩过程需加入少量盐酸的目的是: 。
⑸工业生产过程会产生含Cu2+的废水,向废水加入碱调节pH=8,沉降后废水中Cu2+浓度为 mol/L。(已知Ksp[Cu(OH)2]=5.6×10-20)
⑹氯化亚铜(CuCl)也是一种重要的化工原料。
制备过程:向CuCl2溶液中通入一定量的SO2,加热一段时间后生成CuCl白色沉淀。写出制备CuCl的离子方程式: 。
(14分)
⑴粉碎孔雀石或适当升高温度或搅拌或适当提高酸的浓度
⑵2Fe2++Cl2 = 2Fe3++ 2Cl- ⑶3.7~5.4 BC
⑷抑制CuCl2 水解 ⑸ 5.6×10-8
⑹ 2Cu2++2Cl-+SO2+2H2O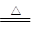 2CuCl↓+4H++SO42- (每空2分)
2CuCl↓+4H++SO42- (每空2分)
【解析】
试题分析:⑴酸溶时,为了提高浸取率可采取的措施有粉碎孔雀石或适当升高温度或搅拌或适当提高酸的浓度。
⑵若溶液A含有的金属离子有Cu2+、Fe2+,则试剂①为Cl2,使亚铁转化为三价铁,通入Cl2发生反应的离子方程式:2Fe2++Cl2 = 2Fe3++ 2Cl-。
⑶加入试剂②的目的是调节pH至a,a的范围是3.7~5.4保证铁离子沉淀完全;
为避免引入杂质离子,试剂②可选用:氧化铜 ;氢氧化铜 。
⑷由溶液C获得CuCl2·xH2O,实验操作依次是加热浓缩、冷却结晶、过滤和洗涤等操作。加热浓缩过程需加入少量盐酸的目的是:抑制CuCl2 水解。
⑸工业生产过程会产生含Cu2+的废水,向废水加入碱调节pH=8,C(OH-)=1×10-6所以沉降后废水中Cu2+浓度=Ksp[Cu(OH)2]/C2(OH-)=5.6×10-8mol/L。(已知Ksp[Cu(OH)2]=5.6×10-20)
⑹氯化亚铜(CuCl)也是一种重要的化工原料。
制备过程:向CuCl2溶液中通入一定量的SO2,加热一段时间后生成CuCl白色沉淀。制备CuCl的离子方程式:2Cu2++2Cl-+SO2+2H2O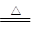 2CuCl↓+4H++SO42-。
2CuCl↓+4H++SO42-。
考点:制备氯化铜晶体实验
点评:此题综合性较强,能够考查学生把所学知识运用到实际问题的能力。

 阅读快车系列答案
阅读快车系列答案(14分)氯化铜晶体(CuCl2·xH2O)是重要的化工原料,可用作催化剂、消毒剂等。用孔雀石[主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物]制备氯化铜晶体,方案如下: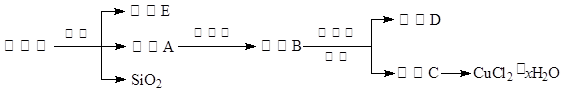
已知:有关金属离子从开始沉淀到沉淀完全时溶液的pH: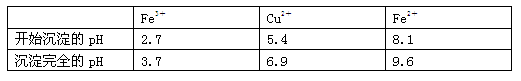
⑴酸溶时,为了提高浸取率可采取的措施有 。(写出一点)
⑵若溶液A含有的金属离子有Cu2+、Fe2+,则试剂①为Cl2,通入Cl2发生反应的离子方程式: 。
⑶加入试剂②的目的是调节pH至a,a的范围是 ;
为避免引入杂质离子,试剂②可选用 。
| A.氨水 | B.氧化铜 | C.氢氧化铜 | D.氢氧化钠 |
⑸工业生产过程会产生含Cu2+的废水,向废水加入碱调节pH=8,沉降后废水中Cu2+浓度为 mol/L。(已知Ksp[Cu(OH)2]=5.6×10-20)
⑹氯化亚铜(CuCl)也是一种重要的化工原料。
制备过程:向CuCl2溶液中通入一定量的SO2,加热一段时间后生成CuCl白色沉淀。写出制备CuCl的离子方程式: 。