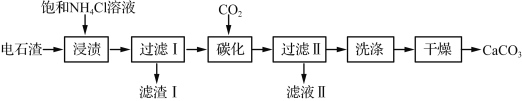
题目内容
【题目】COP、FeS2、NiS2等物质对电化学氢析出反应有良好的催化活性和稳定性。请回答下列问题:
(1)基态Co原子价层电子的电子排布图(轨道表达式)为________________,基态P原子的电子占据最高能级的电子云轮廓图为________形。
(2)PH3的沸点________(填“高于”或“低于”)NH3,原因是______________。
(3)PH3分子的空间结构为__________,其中存在的共价键类型为_________________,P原子的杂化方式为______________________
(4)下图为白磷(P4)的晶胞示意图,晶胞的边长为a nm,设阿伏加德罗常数的数值为NA,其晶体密度的计算表达式为______g·cm-3。

【答案】![]() 哑铃形或纺锤形 低于 NH3分子间存在氢键,PH3不存在分子间氢键 三角锥形 σ键或极性共价键 sp3
哑铃形或纺锤形 低于 NH3分子间存在氢键,PH3不存在分子间氢键 三角锥形 σ键或极性共价键 sp3 ![]()
【解析】
(1)Co为过渡元素,价电子包括最外层电子和次外层d能级电子,基态Co原子价层电子的电子排布图为![]() ;基态P原子电子排布式为[Ne]3s23p3,电子占据最高能级的电子云轮廓图为哑铃形或纺锤形;
;基态P原子电子排布式为[Ne]3s23p3,电子占据最高能级的电子云轮廓图为哑铃形或纺锤形;
(2)NH3分子间存在氢键,PH3不存在分子间氢键,因此NH3的沸点高于PH3;
(3)PH3中心原子P有3个σ键,孤电子对数为(5-3×1)/2=1,PH3空间构型为三角锥形;存在的共价键类型为σ键或极性共价键;P原子的杂化类型为sp3;
(4)晶胞中白磷分子位于顶点和面心,个数为8×1/8+6×1/2=4,晶胞的质量为4×31×4/NAg,晶胞的体积为(a×10-7)3cm3,根据密度的定义,ρ=![]() g/cm3;
g/cm3;

练习册系列答案
 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目