题目内容
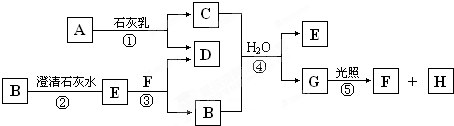
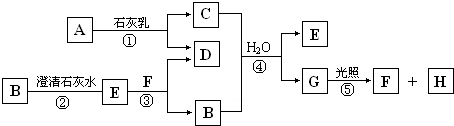
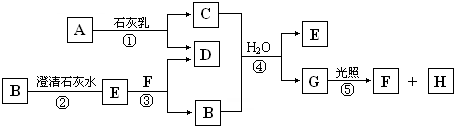
如图中A~H均为中学化学中常见的物质,A、B、H为气体,反应①是重要的工业反应,它们之间有如下转化关系.(反应中生成的水已略去)
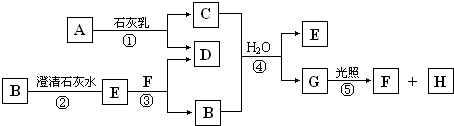
请回答以下问题:
(1)B是
(2)工业上常利用反应①制取漂白粉,该反应的化学方程式为:
(3)A中元素的原子结构示意图为
 .
.
(4)F在溶液中的电离方程式为
(5)上述反应中属于氧化还原反应是

请回答以下问题:
(1)B是
CO2
CO2
,D是CaCl2
CaCl2
,G是HClO
HClO
,H是O2
O2
.(填化学式)(2)工业上常利用反应①制取漂白粉,该反应的化学方程式为:
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
,漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
.(3)A中元素的原子结构示意图为


(4)F在溶液中的电离方程式为
HCl=H++Cl-
HCl=H++Cl-
.(5)上述反应中属于氧化还原反应是
①⑤
①⑤
(填写序号)分析:反应①是重要的工业反应,A是气体,应为Cl2,与石灰乳反应生成CaCl2和Ca(ClO)2,G在光照下反应,应为HClO,生成气体H为O2,则F为HCl,所以C应为Ca(ClO)2,D为CaCl2,无色气体B应为CO2,沉淀E为CaCO3,以上推断符合题目转化关系,结合物质的性质和题目要求解答该题.
解答:解:反应①是重要的工业反应,A是气体,应为Cl2,与石灰乳反应生成CaCl2和Ca(ClO)2,G在光照下反应,应为HClO,生成气体H为O2,则F为HCl,所以C应为Ca(ClO)2,D为CaCl2,无色气体B应为CO2,沉淀E为CaCO3,
(1)由以上分析可知B为CO2,D为CaCl2,G为HClO,H为O2,故答案为:CO2,CaCl2,HClO,O2;
(2)反应①为Cl2和Ca(OH)2的反应,生成CaCl2和Ca(ClO)2,反应的方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,由于HClO的酸性比碳酸弱,漂白粉在空气中可发生:Ca(ClO,)2+CO2+H2O=CaCO3↓+2HClO,
故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;Ca(ClO,)2+CO2+H2O=CaCO3↓+2HClO;
(3)A为Cl2,Cl元素原子核外有3个电子层,最外层电子数为7,原子结构示意图为 ,故答案为:
,故答案为: ;
;
(4)F为HCl,为强电解质,在溶液中完全电离,电离方程式为HCl=H++Cl-,故答案为:HCl=H++Cl-;
(5)反应①⑤中,有单质参加反应,肯定属于氧化还原反应,故答案为:①⑤.
(1)由以上分析可知B为CO2,D为CaCl2,G为HClO,H为O2,故答案为:CO2,CaCl2,HClO,O2;
(2)反应①为Cl2和Ca(OH)2的反应,生成CaCl2和Ca(ClO)2,反应的方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,由于HClO的酸性比碳酸弱,漂白粉在空气中可发生:Ca(ClO,)2+CO2+H2O=CaCO3↓+2HClO,
故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;Ca(ClO,)2+CO2+H2O=CaCO3↓+2HClO;
(3)A为Cl2,Cl元素原子核外有3个电子层,最外层电子数为7,原子结构示意图为
 ,故答案为:
,故答案为: ;
;(4)F为HCl,为强电解质,在溶液中完全电离,电离方程式为HCl=H++Cl-,故答案为:HCl=H++Cl-;
(5)反应①⑤中,有单质参加反应,肯定属于氧化还原反应,故答案为:①⑤.
点评:本题考查无机物的推断,题目难度不大,本题注意把握常见物质工业用途以及常见反应,为解答该题的关键,注意把握相关物质的性质,学习中注意积累.

练习册系列答案
 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案
相关题目
 如图中A~H均为中学化学中常见的物质,它们之间有如下转化关系.其中A、C均为金属单质,C与水反应生成D和最轻的气体,D、H的焰色反应均呈黄色,在通常状况下E(氢氧化物)跟NaOH或盐酸均可发生复分解反应(反应过程中生成的水及其他产物已略去).
如图中A~H均为中学化学中常见的物质,它们之间有如下转化关系.其中A、C均为金属单质,C与水反应生成D和最轻的气体,D、H的焰色反应均呈黄色,在通常状况下E(氢氧化物)跟NaOH或盐酸均可发生复分解反应(反应过程中生成的水及其他产物已略去).