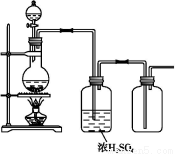
题目内容
Na2S2O3·5H2O 俗称“海波”,是常用的脱氧剂、定影剂和还原剂;它是无色易溶于水的晶体,不溶于乙醇,在20 ℃ 和70 ℃ 时的溶解度分别为60.0 g 和212 g,Na2S2O3·5H2O于40~45 ℃熔化,48 ℃分解。下面是实验室制备及相关性质实验。
制备海波的反应原理:Na2SO3+S Na2S2O3
Na2S2O3
制备海波的流程:
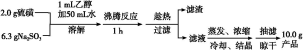
(1)实验开始时用1 mL乙醇润湿硫粉的作用是 。
A.有利于亚硫酸钠与硫磺的充分接触
B.防止亚硫酸钠溶解
C.控制溶液的pH
D.提高产品的纯度
(2)趁热过滤的原因是 。
(3)滤液不采用直接蒸发结晶的可能原因是 。
(4)抽滤过程中需要洗涤产品晶体,下列液体最适合的是 。
A.无水乙醇 B.饱和NaCl溶液 C.水 D.滤液
(5)产品的纯度测定:取所得产品10.0 g,配成500 mL溶液,再从中取出25 mL溶液于锥形瓶中,滴加几滴淀粉作指示剂,然后用0.050 mol/L的标准碘水溶液滴定,重复三次,平均消耗20 mL标准碘水,涉及的滴定反应方程式为:I2+2Na2S2O3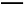 2NaI+Na2S4O6。产品中的Na2S2O3·5H2O的纯度为 %。
2NaI+Na2S4O6。产品中的Na2S2O3·5H2O的纯度为 %。
(1)A
(2)防止温度降低而使Na2S2O3晶体析出
(3)直接蒸发结晶易使Na2S2O3·5H2O熔化、分解
(4)A
(5)99.2
【解析】(1)因为硫单质不溶于水,微溶于酒精,这里用少量乙醇的目的是让亚硫酸钠与硫磺充分接触,利于
反应。
(2)从题中所给信息看:在高温下Na2S2O3溶解度比较大,不会析出。
(3)Na2S2O3·5H2O熔化、分解温度很低,只有40多度,如果采取蒸发结晶的方法,很容易超过该温度而使制得的Na2S2O3·5H2O熔化、分解。所以采用了加热蒸发到一定浓度,降温结晶的方法。
(4)Na2S2O3·5H2O不溶于乙醇,所以采用无水乙醇洗涤。
(5)n(I2)=0.02 L×0.050 mol·L-1×20=0.02 mol,n(Na2S2O3)=2n(I2)=0.04 mol,m(Na2S2O3·5H2O)=0.04 mol×248 g·mol-1=9.92 g,Na2S2O3·5H2O的纯度为: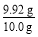 ×100%=99.2%。
×100%=99.2%。

下表是五种银盐的溶度积常数(25 ℃):
化学式 | AgCl | Ag2SO4 | Ag2S | AgBr | AgI |
溶度积 | 1.8×10-10 | 1.4×10-5 | 6.3×10-50 | 7.7×10-13 | 8.51×10-16 |
下列说法不正确的是( )
A.五种物质在常温下Ag2SO4饱和溶液中c(Ag+)最大
B.将氯化银溶解于水后,向其中加入Na2S,则可以生成黑色沉淀
C.对于氯化银、溴化银和碘化银三种物质在常温下的饱和溶液中c(Ag+)随着氯、溴、碘的顺序增大
D.沉淀溶解平衡的建立是有条件的,外界条件改变时,平衡也会发生移动