题目内容
4.某乙醇水溶液的质量分数为w%,物质的量浓度为cmol/L,密度为dg/mL,1Kg这种溶液中含有的乙醇是( )| A. | 46C | B. | $\frac{c}{d}$mol | C. | c mol | D. | 1000dw g |
分析 1Kg该溶液中含有溶质的质量为:m=ρVω=1000g×w%=10wg;还可以根据V=$\frac{m}{ρ}$计算出溶液体积,然后根据m=cV计算出乙醇的物质的量.
解答 解:1Kg该溶液中含有溶质的质量为:m=ρVω=1000g×w%=10wg,故D错误;
该1Kg乙醇溶液的体积为:V=$\frac{1000g}{dg/mL}$=$\frac{1000}{d}$mL=$\frac{1}{d}$L,所以乙醇的物质的量为:n=c•V=cmol/L×$\frac{1}{d}$L=$\frac{c}{d}$ mol,故AC错误、B正确;
故选B.
点评 本题考查溶液的质量分数、物质的量浓度的有关计算,题目难度中等,明确物质的量浓度与溶质质量分数、物质的量、摩尔质量等物理量之间的关系为解答关键,试题培养了学生灵活应用能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.下列关于如图所示原电池装置的叙述中,正确的是( )
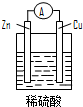

| A. | 铜片是负极 | B. | 铜片表面反应为:Cu-2e- Cu2+ | ||
| C. | 电流从锌片经导线流向铜片 | D. | 氢离子在铜片表面被还原 |
15.下列说法中正确的是( )
| A. | 金属导电的原因是在外加电场的作用下金属产生自由电子,电子定向运动 | |
| B. | 金属晶体的熔点和沸点都很高 | |
| C. | 金属元素和非金属元素形成的化合物一定是离子化合物 | |
| D. | 离子化合物中一定含有离子键 |
12.其它条件不变,升高温度下列数据不一定增大的是( )
| A. | 可逆反应的化学平衡常数K | B. | 0.1mol/LCH3COONa溶液的PH | ||
| C. | 水的离子积常数Kw | D. | 弱电解质的电离程度 |
9.能用于鉴别乙醇、己烷、己烯、乙酸溶液、苯酚溶液等五种无色液体的试剂组是( )
| A. | FeCl3溶液、NaOH溶液 | B. | Cu(OH)2悬浊液、紫色石蕊试液 | ||
| C. | 紫色石蕊试液、溴水 | D. | FeCl3溶液、溴水引发剂 |
16.下列叙述错误的是( )
| A. | 阴、阳离子通过静电吸引所形成的化学键,叫离子键 | |
| B. | 活泼金属元素与活泼非金属元素化合时,形成的是离子键 | |
| C. | 某元素最外层只有一个电子,它与卤素原子结合时所形成的化学键不一定是离子键 | |
| D. | 全部由非金属元素组成的化合物可能是离子化合物 |
13.不能使品红溶液褪色的是( )
| A. | 氯气 | B. | 二氧化硫 | C. | 活性炭 | D. | 硫化氢 |
 ,在催化剂存在条件下1molD与2molH2反应可以生成乙;丙中含有两个-CH3
,在催化剂存在条件下1molD与2molH2反应可以生成乙;丙中含有两个-CH3
 .
. .
. 将2.5g碳酸钠、碳酸氢钠和氢氧化钠的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol•L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示:
将2.5g碳酸钠、碳酸氢钠和氢氧化钠的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol•L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示: