题目内容
常温下,将某一元酸HA和NaOH溶液等体积混合,分别进行编号为①、②、③的实验,实验数据记录如下表,请回答:
(1)根据①组实验情况,分析混合溶液的pH=9的原因是 (用反应的离子方程式表示),在该溶液中下列关系式不正确的是(填序号字母) .
A.c(Na+)+c(H+)=c(OH-)+c(A-)
B.c(Na+)=c(HA)+c(A-)
C.c(HA)+c(H+)=c(OH-)+c(Na+)
D.c(Na+)+c(H+)=c(OH-)+c(A-)+c(HA)
(2)②组情况表明,c 0.2mol?L-1,(选填“>”、“<”或“=”)
(3)从③组实验结果分析,说明HA的电离程度 NaA的水解程度(选填“>”、“<”或“=”),离子浓度由大到小的顺序是 .
(4)水是我们熟悉的物质,正如同学们所知道的,水能“分裂”出一个质子而离解,此处打引号是由于分裂出来的质子不是以游离状态存在于真实的化学体系中,而是立即与另一水分子结合:H2O+H2O?H3O++OH-;K1=
氢氧根离子可进一步离解:OH-+H2O?H3O++O2-;K2=
①计算25℃时K1的值.
②1.8×10-16
已知25℃时K2=10-36,计算在多少体积的水里含有一个氧负离子?
| 实验 编号 |
HA物质的量 | NaOH物质的量 | 混合溶液 |
| 浓度(mol?L-1) | 浓度(mol?L-1) | 的pH | |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
A.c(Na+)+c(H+)=c(OH-)+c(A-)
B.c(Na+)=c(HA)+c(A-)
C.c(HA)+c(H+)=c(OH-)+c(Na+)
D.c(Na+)+c(H+)=c(OH-)+c(A-)+c(HA)
(2)②组情况表明,c
(3)从③组实验结果分析,说明HA的电离程度
(4)水是我们熟悉的物质,正如同学们所知道的,水能“分裂”出一个质子而离解,此处打引号是由于分裂出来的质子不是以游离状态存在于真实的化学体系中,而是立即与另一水分子结合:H2O+H2O?H3O++OH-;K1=
| c(H3O+)c(OH-) |
| c(H2O) |
氢氧根离子可进一步离解:OH-+H2O?H3O++O2-;K2=
| c(H3O+)c(O2-) |
| c(OH-) |
①计算25℃时K1的值.
②1.8×10-16
已知25℃时K2=10-36,计算在多少体积的水里含有一个氧负离子?
考点:离子浓度大小的比较,弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:(1)二者恰好反应生成NaA,溶液呈碱性,说明NaA是强碱弱酸盐,酸根离子水解导致溶液呈碱性;溶液中存在电荷守恒、物料守恒;
(2)NaA溶液呈碱性,要使混合溶液呈中性,则HA应该稍微过量;
(3)等物质的量浓度的NaA和HA溶液呈酸性,说明酸的电离程度大于酸根离子水解程度;
(4)①c(H3O+)?c(OH-)=Kw,c(H2O)=
=55.6mol/L,根据 K1=
进行计算;
②水中c(H3O+)=c(OH-),根据K2=
计算氧负离子的物质的量浓度,再根据水的体积与氧负离子个数之间的关系列比例式,从而得出正确结论.
(2)NaA溶液呈碱性,要使混合溶液呈中性,则HA应该稍微过量;
(3)等物质的量浓度的NaA和HA溶液呈酸性,说明酸的电离程度大于酸根离子水解程度;
(4)①c(H3O+)?c(OH-)=Kw,c(H2O)=
| ||
| 1L |
| c(H3O+).c(OH-) |
| c(H2O) |
②水中c(H3O+)=c(OH-),根据K2=
| c(H3O+)c(O2-) |
| c(OH-) |
解答:
解:(1)二者恰好反应生成NaA,溶液呈碱性,说明NaA是强碱弱酸盐,酸根离子水解导致溶液呈碱性,水解离子方程式为A-+H2O?HA+OH-,
A.根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(A-),故正确;
B.根据物料守恒得c(Na+)=c(HA)+c(A-),故正确;
C.根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(A-),根据物料守恒得c(Na+)=c(HA)+c(A-),所以c(HA)+c(H+)=c(OH-),故错误;
D.根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(A-),故D错误;
故答案为:A-+H2O?HA+OH-;CD;
(2)NaA溶液呈碱性,要使混合溶液呈中性,则HA应该稍微过量,二者体积相等,所以c>0.2mol?L-1,故答案为:>;
(3)等物质的量浓度的NaA和HA溶液呈酸性,说明酸的电离程度大于酸根离子水解程度,溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒得c(A-)>c(Na+),溶液中酸的电离较微弱,所以c(Na+)>c(H+),则溶液中离子浓度大小顺序是c(A-)>c(Na+)>c(H+)>c(OH-),故答案为:c(A-)>c(Na+)>c(H+)>c(OH-);
(4)①c(H3O+)?c(OH-)=Kw,c(H2O)=
=55.6mol/L,K1=
=
=1.8×10-16,故答案为:1.8×10-16;
②水中c(H3O+)=c(OH-),K2=
,c(O2-)=K2?c(OH-)/c(H3O+)=K2=10-36,1L水中氧负离子的个数=6.02×1023×10-36=6.02×10-13,设xL水中含有一个氧负离子,则1:6.02×10-13=x:1,x=1.7×1012,
故答案为:1.7×1012L水中有一个氧负离子.
A.根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(A-),故正确;
B.根据物料守恒得c(Na+)=c(HA)+c(A-),故正确;
C.根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(A-),根据物料守恒得c(Na+)=c(HA)+c(A-),所以c(HA)+c(H+)=c(OH-),故错误;
D.根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(A-),故D错误;
故答案为:A-+H2O?HA+OH-;CD;
(2)NaA溶液呈碱性,要使混合溶液呈中性,则HA应该稍微过量,二者体积相等,所以c>0.2mol?L-1,故答案为:>;
(3)等物质的量浓度的NaA和HA溶液呈酸性,说明酸的电离程度大于酸根离子水解程度,溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒得c(A-)>c(Na+),溶液中酸的电离较微弱,所以c(Na+)>c(H+),则溶液中离子浓度大小顺序是c(A-)>c(Na+)>c(H+)>c(OH-),故答案为:c(A-)>c(Na+)>c(H+)>c(OH-);
(4)①c(H3O+)?c(OH-)=Kw,c(H2O)=
| ||
| 1L |
| c(H3O+).c(OH-) |
| c(H2O) |
| 10-14 |
| 55.6 |
②水中c(H3O+)=c(OH-),K2=
| c(H3O+)c(O2-) |
| c(OH-) |
故答案为:1.7×1012L水中有一个氧负离子.
点评:本题考查了弱电解质的电离、离子浓度大小比较等知识点,根据混合溶液酸碱性确定酸的强弱、离子浓度大小,难点是(4)中根据1L水中氧负离子浓度确定水的体积与氧负离子个数之间的关系,难度中等.

练习册系列答案
相关题目
设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A、22.4L甲烷中含有C-H键的数目为4NA |
| B、46g NO2和N2O4的混合气体中含有原子总数为3NA |
| C、25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA |
| D、Na2O2与足量H2O反应,共生成0.1mol O2,转移电子的数目为0.4NA |
下列有机实验操作或叙述正确的是( )
| A、将乙烯和乙炔气体分别通入溴的四氯化碳溶液中前者褪色,后者不褪色 |
| B、鉴别乙烷和乙炔可将二者分别通入酸性高锰酸钾溶液中 |
| C、苯能使溴水褪色是因为二者反应生成了溴苯 |
| D、工业上制备氯乙烯可用乙炔在一定条件下与氯化氢发生取代反应 |
下列装置或操作能达到实验目的(必要的夹持装置及石棉网已省略)的是( )
A、 酸性KMnO4溶液中出现气泡且颜色逐渐褪去 |
B、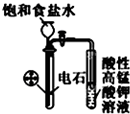 实验室制乙炔并验证其性质 |
C、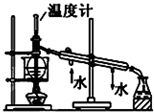 实验室中分馏石油 |
D、 分离碘酒中的碘和酒精 |
氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为( )
| A、氨气分子是极性分子而甲烷是非极性分子 |
| B、NH3分子中有一对未成键的弧对电子,它对成键电子的排斥作用较强 |
| C、NH3为分子中N原子形成3个杂化轨道,CH4中C原子形成4个杂化轨道 |
| D、两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化 |
 如图所示,U形管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混合气体,假定氯气在水中的溶解度可以忽略.将封闭有甲烷和氯气的混合气体的装置放置在有光亮的地方,让混合气体缓慢地反应一段时间.
如图所示,U形管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混合气体,假定氯气在水中的溶解度可以忽略.将封闭有甲烷和氯气的混合气体的装置放置在有光亮的地方,让混合气体缓慢地反应一段时间.

 水解反应(取代反应)A、B、C、D均为含苯环的有机物,且相对分子质量B>A>C.已知有机物A的结构简式为
水解反应(取代反应)A、B、C、D均为含苯环的有机物,且相对分子质量B>A>C.已知有机物A的结构简式为