题目内容
埋在地下的自来水管,在下列情况下被腐蚀的速度最慢的是
| A.在含有铁元素的较多的酸性土壤中 |
| B.在潮湿、疏松的土壤中 |
| C.在自来水的铁管上用导线连接一块锌片后,再埋入不透气的土壤中 |
| D.在自来水的铁管上用导线连接一块铜片后,再埋入潮湿、疏松的土壤中 |
C
C.构成原电池,牺牲阳极,阴极保护法,负极腐蚀速率加快,正极得到保护。

练习册系列答案
相关题目
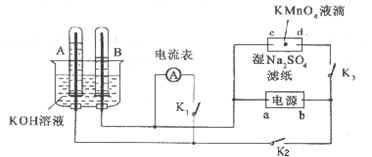
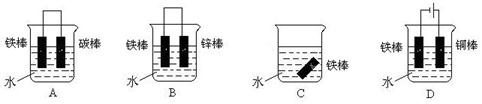
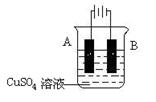
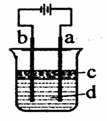
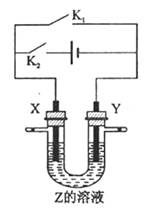
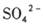 移向Y极
移向Y极