题目内容
【题目】太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置。其材料有单晶硅,还有铜、锗、镓、硒等化合物。
(1)亚铜离子(Cu+)基态时电子排布式为_______________。,其电子占据的原子轨道数目为___________个。
(2)左下图表示碳、硅和磷元素的四级电离能变化趋势,其中表示磷的曲线是_______________(填标号a,b,c)。

(3)单晶硅可由二氧化硅制得,二氧化硅晶体结构如上图所示,在二氧化硅晶体中,Si、 O原子所连接的最小环为十二元环,则每个Si原子连接 _________个十二元环。
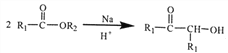
(4)氮化镓(GaN)的晶体结构如右图所示。常压下,该晶体熔 点1700℃,故其晶体类型为_______;判断该晶体结构中存在配位键的依据是________________。
(5)与镓元素处于同一主族的硼元素具有缺电子性,因而硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]-。[B(OH)4]-中B原子的杂化轨道类型为________________;不考虑空间构型,[B(OH)4]-中原子的成键方式用结构简式表示为_______________________;
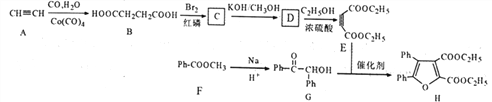
(6)某光电材料由锗的氧化物与铜的氧化物按一定比例熔合而成,其中锗的氧化物晶胞结构如右图所示,该物质的化学式为________。已知该晶 体密度为ρg.cm-3,晶胞边长为a pm。则锗的相对原子质量为_____________(用含ρ和a的关系式表示)。
【答案】 1s22s22p63s23p63d10 14 b 12 原子晶体 GaN晶体中,毎1个Ga原子与4个N 原子结合,而Ga原子只有3个价电子,故需提供1个空轨道形成配位键 sp3 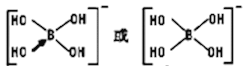 GeO 1/4ρa3NA10-30 -16
GeO 1/4ρa3NA10-30 -16
【解析】本题分析:本题主要考查原子结构与晶体结构。
(1)亚铜离子(Cu+)基态时电子排布式为1s22s22p63s23p63d10,其电子占据的原子轨道数目为14个。
(2)磷的化合价易呈+3,b曲线的第四电离能突增,所以表示磷的曲线是b。
(3)在二氧化硅晶体中,Si、O原子所连接的最小环为十二元环,则每个Si原子连接12个十二元环。
(4)常压下,该晶体熔点1700℃,故其晶体类型为原子晶体;判断该晶体结构中存在配位键的依据是GaN晶体中,毎1个Ga原子与4个N 原子结合,而Ga原子只有3个价电子,故需提供1个空轨道形成配位键。
(5)[B(OH)4]-中B原子的价层电子对是4,其杂化轨道类型为sp3;不考虑空间构型,[B(OH)4]-中原子的成键方式用结构简式表示为: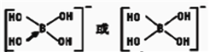 ;
;
(6)晶胞中含有4个氧原子,4个锗原子,该物质的化学式为GeO。设锗的相对原子质量为x,则GeO的相对分子质量为x+16,根据题可得4(x+16)=ρgcm-3×(acm×10-10)3NA,x=1/4ρa3NA10-30 -16。

 阅读快车系列答案
阅读快车系列答案