题目内容
硫酸亚铁与氢氧化钠制备氢氧化亚铁的过程中会出现一种绿色物质A(只含Fe、S、O、H四种元素).称取此物质32.200g,用稀盐酸溶液恰好完全溶解后,配成250mL样品溶液待用.
(1)硫酸亚铁片可以用于治疗缺铁性贫血症,每片含铁元素0.111g,则一瓶60片的药品中硫酸亚铁的质量为______g.
(2)移取样品溶液50.00mL,加入0.560g铁粉正好完全反应,得到溶液B(假设溶液体积不变).根据以上数据可计算出32.200g A物质中铁离子的物质的量为______mol.
(3)将B溶液稀释成500mL后取出20.00mL,用0.0250mol.L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液22.40mL.试计算:
(1)B溶液中Fe2+的物质的量浓度.
(2)32.200g A物质中亚铁离子的物质的量.
(4)移取样品溶液100.00mL,加入足量BaCl2溶液,过滤、烘干、冷却,得固体9.320g.根据计算结果写出A的化学式.
解:(1)60片药品中铁元素的质量=0.111g×60=6.66g,则一瓶60片的药品中硫酸亚铁的质量=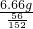 =18.077g,
=18.077g,
故答案为:18.077;
(2)0.560g铁粉的物质的量=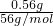 =0.01mol,发生反应Fe+2Fe3+=3Fe2+,故50mL溶液中铁离子的物质的量=0.01mol×2=0.02mol,250mL溶液中铁离子的物质的量=0.02mol×
=0.01mol,发生反应Fe+2Fe3+=3Fe2+,故50mL溶液中铁离子的物质的量=0.01mol×2=0.02mol,250mL溶液中铁离子的物质的量=0.02mol×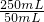 =0.1mol,即32.200g A物质中铁离子的物质的量为0.1mol,
=0.1mol,即32.200g A物质中铁离子的物质的量为0.1mol,
故答案为:0.1;
(3)①B溶液含有亚铁离子,发生反应5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O,令B溶液中Fe2+的物质的量浓度为cmol/L,稀释后浓度为0.1mol/L,则:
5Fe2+~~~~~~~~~~MnO4-
5 1
0.1cmol/L×0.02L 0.0250mol.L-1×0.02240L
故5:1=0.1cmol/L×0.02L:0.0250mol.L-1×0.02240L,
解得c=1.4mol/L,
答:B溶液中Fe2+的物质的量浓度1.4mol/L;
②50mLB溶液中亚铁离子的物质的量=1.4mol/L×0.05L=0.07mol,根据(2)中计算可得50mL样品溶液中反应生成的亚铁离子的物质的量=0.01mol×3=0.03mol,故计算50mL样品中含有的亚铁离子物质的量=0.07mol-0.03mol=0.04mol,故250mL溶液中亚铁离子的物质的量=0.04mol×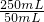 =0.2mol,即32.200g A物质中亚铁离子的物质的量为0.2mol,
=0.2mol,即32.200g A物质中亚铁离子的物质的量为0.2mol,
答:32.200g A物质中亚铁离子的物质的量为0.2mol;
(4)得固体9.320g为硫酸钡,硫酸钡的物质的量=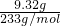 =0.04mol,故250mL溶液中硫酸根的物质的量═0.04mol×
=0.04mol,故250mL溶液中硫酸根的物质的量═0.04mol× =0.1mol,即32.200g A物质中硫酸根的物质的量为0.1mol,
=0.1mol,即32.200g A物质中硫酸根的物质的量为0.1mol,
故写成氧化物形式,有氧化铁、氧化亚铁、三氧化硫、水,
氧化铁为0.05mol,质量为0.05mol×160g/mol=8g,
氧化亚铁为0.2mol,质量为0.2mol×72g/mol=14.4g,
三氧化硫为0.1mol,质量为0.1mol×80g/mol=8g
故水的质量为32.2g-8g-14.4g-8g=1.8g,物质的量=0.1mol,
故n(Fe2O3):n(FeO):n(SO3):n(H2O)=0.05mol:0.2mol:0.1mol:0.1mol=1:4:2:2,
故A的化学式可以写成Fe2O3?4FeO?2SO3?2H2O,
答:A的化学式为Fe2O3?4FeO?2SO3?2H2O.
分析:(1)计算60片药品中铁元素的质量,再根据硫酸亚铁中铁元素的质量分数计算;
(2)根据n= 计算0.560g铁粉的物质的量,发生反应Fe+2Fe3+=3Fe2+,据此计算50mL溶液中铁离子的物质的量,进而计算250mL溶液中铁离子的物质的量;
计算0.560g铁粉的物质的量,发生反应Fe+2Fe3+=3Fe2+,据此计算50mL溶液中铁离子的物质的量,进而计算250mL溶液中铁离子的物质的量;
(3)①B溶液含有亚铁离子,发生反应5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O,令B溶液中Fe2+的物质的量浓度为cmol/L,稀释后浓度为0.1mol/L,根据方程式计算;
②根据n=cV计算50mLB溶液中亚铁离子的物质的量,根据(2)中计算可得50mL样品溶液中反应生成的亚铁离子的物质的量,进而计算50mL样品中含有的亚铁离子物质的量,进而计算250mL溶液中亚铁离子的物质的量;
(4)得固体9.320g为硫酸钡,根据n= 计算硫酸钡的物质的量,进而计算250mL溶液中硫酸根的物质的量,
计算硫酸钡的物质的量,进而计算250mL溶液中硫酸根的物质的量,
故写成氧化物形式,有氧化铁、氧化亚铁、三氧化硫、水,计算水的质量,进而计算水的物质的量,确定氧化铁、氧化亚铁、三氧化硫、水的物质的量之比,据此书写.
点评:本题考查混合物的有关计算、滴定计算,过程复杂,计算量很大,对学生的心理素质有很高的要求,难度很大,为易错题目.
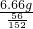 =18.077g,
=18.077g,故答案为:18.077;
(2)0.560g铁粉的物质的量=
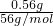 =0.01mol,发生反应Fe+2Fe3+=3Fe2+,故50mL溶液中铁离子的物质的量=0.01mol×2=0.02mol,250mL溶液中铁离子的物质的量=0.02mol×
=0.01mol,发生反应Fe+2Fe3+=3Fe2+,故50mL溶液中铁离子的物质的量=0.01mol×2=0.02mol,250mL溶液中铁离子的物质的量=0.02mol×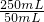 =0.1mol,即32.200g A物质中铁离子的物质的量为0.1mol,
=0.1mol,即32.200g A物质中铁离子的物质的量为0.1mol,故答案为:0.1;
(3)①B溶液含有亚铁离子,发生反应5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O,令B溶液中Fe2+的物质的量浓度为cmol/L,稀释后浓度为0.1mol/L,则:
5Fe2+~~~~~~~~~~MnO4-
5 1
0.1cmol/L×0.02L 0.0250mol.L-1×0.02240L
故5:1=0.1cmol/L×0.02L:0.0250mol.L-1×0.02240L,
解得c=1.4mol/L,
答:B溶液中Fe2+的物质的量浓度1.4mol/L;
②50mLB溶液中亚铁离子的物质的量=1.4mol/L×0.05L=0.07mol,根据(2)中计算可得50mL样品溶液中反应生成的亚铁离子的物质的量=0.01mol×3=0.03mol,故计算50mL样品中含有的亚铁离子物质的量=0.07mol-0.03mol=0.04mol,故250mL溶液中亚铁离子的物质的量=0.04mol×
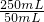 =0.2mol,即32.200g A物质中亚铁离子的物质的量为0.2mol,
=0.2mol,即32.200g A物质中亚铁离子的物质的量为0.2mol,答:32.200g A物质中亚铁离子的物质的量为0.2mol;
(4)得固体9.320g为硫酸钡,硫酸钡的物质的量=
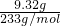 =0.04mol,故250mL溶液中硫酸根的物质的量═0.04mol×
=0.04mol,故250mL溶液中硫酸根的物质的量═0.04mol× =0.1mol,即32.200g A物质中硫酸根的物质的量为0.1mol,
=0.1mol,即32.200g A物质中硫酸根的物质的量为0.1mol,故写成氧化物形式,有氧化铁、氧化亚铁、三氧化硫、水,
氧化铁为0.05mol,质量为0.05mol×160g/mol=8g,
氧化亚铁为0.2mol,质量为0.2mol×72g/mol=14.4g,
三氧化硫为0.1mol,质量为0.1mol×80g/mol=8g
故水的质量为32.2g-8g-14.4g-8g=1.8g,物质的量=0.1mol,
故n(Fe2O3):n(FeO):n(SO3):n(H2O)=0.05mol:0.2mol:0.1mol:0.1mol=1:4:2:2,
故A的化学式可以写成Fe2O3?4FeO?2SO3?2H2O,
答:A的化学式为Fe2O3?4FeO?2SO3?2H2O.
分析:(1)计算60片药品中铁元素的质量,再根据硫酸亚铁中铁元素的质量分数计算;
(2)根据n=
 计算0.560g铁粉的物质的量,发生反应Fe+2Fe3+=3Fe2+,据此计算50mL溶液中铁离子的物质的量,进而计算250mL溶液中铁离子的物质的量;
计算0.560g铁粉的物质的量,发生反应Fe+2Fe3+=3Fe2+,据此计算50mL溶液中铁离子的物质的量,进而计算250mL溶液中铁离子的物质的量;(3)①B溶液含有亚铁离子,发生反应5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O,令B溶液中Fe2+的物质的量浓度为cmol/L,稀释后浓度为0.1mol/L,根据方程式计算;
②根据n=cV计算50mLB溶液中亚铁离子的物质的量,根据(2)中计算可得50mL样品溶液中反应生成的亚铁离子的物质的量,进而计算50mL样品中含有的亚铁离子物质的量,进而计算250mL溶液中亚铁离子的物质的量;
(4)得固体9.320g为硫酸钡,根据n=
 计算硫酸钡的物质的量,进而计算250mL溶液中硫酸根的物质的量,
计算硫酸钡的物质的量,进而计算250mL溶液中硫酸根的物质的量,故写成氧化物形式,有氧化铁、氧化亚铁、三氧化硫、水,计算水的质量,进而计算水的物质的量,确定氧化铁、氧化亚铁、三氧化硫、水的物质的量之比,据此书写.
点评:本题考查混合物的有关计算、滴定计算,过程复杂,计算量很大,对学生的心理素质有很高的要求,难度很大,为易错题目.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
(2011?宝鸡一模)下表中实验操作能达到实验目的或得出正确结论的是( )
|
下列叙述中,正确的是( )
| A、Mg在空气中燃烧,产物只有MgO | B、焊接金属、灯泡填充、贮存粮食、罐头、水果等,常用氮气作保护气以防止氧化或腐烂 | C、与相同浓度的盐酸反应生成氢气的速率:纯铁>生铁 | D、制备氢氧化亚铁时,向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅拌,即可制得白色的氢氧化亚铁 |
某同学创新设计制备氢氧化亚铁的实验方案:
(一)查阅资料
资料1:乙醇不与氢氧化钠或硫酸亚铁反应;乙醇与水互溶,氢氧化钠能溶于乙醇;硫酸亚铁在乙醇中的溶解度比在水中的溶解度小.氮气不能与铜反应.
资料2:几种含铁物质的颜色
(二)实验步骤及现象
①取少量的新制硫酸亚铁晶体于大试管中,向其中加入5mL热蒸馏水,使之充分溶解,然后向其中慢慢加入10mL无水乙醇,这时会发现溶液中有小气泡逸出,静置,直到无小气泡冒出为止.
②另取一支试管,向其中加入半药匙固体氢氧化钠,然后向其中加入5mL无水乙醇,充分溶解后静置.
③用长胶头滴管吸取新配制的氢氧化钠的乙醇溶液,伸入硫酸亚铁溶液中,慢慢地挤压橡胶头,连续吸取几次,使之充分反应,静置片刻,这时在试管底会有大量的白色凝乳状溶胶沉降.
④小心地倒去上层溶液,再向试管中加入3mL无水乙醇洗涤,连续洗涤两三次,这时白色的凝乳状溶胶会变成白色固体,然后倒在滤纸上使乙醇充分挥发,便得到白色固体粉末.
(1)为避免硫酸亚铁在溶于水的过程中被氧化,通常可以向溶液中加入 .向硫酸亚铁溶液中慢慢加入无水乙醇时,产生气泡的原因是 .某同学制备无水乙醇的方法是向无水乙醇(含乙醇的质量分数为99.5%以上)中加入一定量的氯化钙,然后蒸馏得到无水乙醇,你认为此方法能否得到无水乙醇? (填“能”或“否”).
(2)预测上述白色固体的成分可能是 ,保持白色的主要原因是 .
(3)写出生成白色沉淀的化学方程式: .
(三)探究产物成分
Ⅰ利用如图所示装置检验白色粉末的性质:
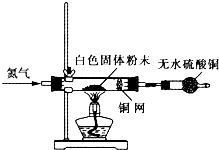
先通入氮气排尽装置内的空气后,继续通入氮气,然后加热硬质试管,观察到无水硫酸铜逐渐变成蓝色;硬质试管里的白色固体粉末逐渐变成黑色;铜网没有明显的颜色变化.当白色固体粉末全部变成黑色粉末时,停止加热,继续通入氮气至硬质试管冷却.
Ⅱ.待冷却后,取适量黑色粉末溶于少量的稀盐酸中,黑色粉末溶解,溶液呈浅绿色,不产生气泡.
Ⅲ.取Ⅱ中的溶液于试管中,滴加酸性高锰酸钾溶液,溶液的紫色褪去.
(4)实验1中,氮气的作用是 ,铜网的作用是 .
(5)证明白色固体粉末中含有+2价铁的实验现象为 :写出符合要求的方程式: .
属于分解反应的化学方程式: ;属于氧化还原反应的离子方程式:
(6)某同学在上述实验的基础上,增加了一个实验确认白色固体中不含+3价铁,设计的实验可能是 .
(一)查阅资料
资料1:乙醇不与氢氧化钠或硫酸亚铁反应;乙醇与水互溶,氢氧化钠能溶于乙醇;硫酸亚铁在乙醇中的溶解度比在水中的溶解度小.氮气不能与铜反应.
资料2:几种含铁物质的颜色
| 化学式 | Fe | FeO | Fe2O3 | Fe3O4 | Fe(OH)2 | Fe(OH)3 |
| 颜色 | 银白色 | 黑色 | 红色 | 黑色 | 白色 | 红褐色 |
①取少量的新制硫酸亚铁晶体于大试管中,向其中加入5mL热蒸馏水,使之充分溶解,然后向其中慢慢加入10mL无水乙醇,这时会发现溶液中有小气泡逸出,静置,直到无小气泡冒出为止.
②另取一支试管,向其中加入半药匙固体氢氧化钠,然后向其中加入5mL无水乙醇,充分溶解后静置.
③用长胶头滴管吸取新配制的氢氧化钠的乙醇溶液,伸入硫酸亚铁溶液中,慢慢地挤压橡胶头,连续吸取几次,使之充分反应,静置片刻,这时在试管底会有大量的白色凝乳状溶胶沉降.
④小心地倒去上层溶液,再向试管中加入3mL无水乙醇洗涤,连续洗涤两三次,这时白色的凝乳状溶胶会变成白色固体,然后倒在滤纸上使乙醇充分挥发,便得到白色固体粉末.
(1)为避免硫酸亚铁在溶于水的过程中被氧化,通常可以向溶液中加入
(2)预测上述白色固体的成分可能是
(3)写出生成白色沉淀的化学方程式:
(三)探究产物成分
Ⅰ利用如图所示装置检验白色粉末的性质:

先通入氮气排尽装置内的空气后,继续通入氮气,然后加热硬质试管,观察到无水硫酸铜逐渐变成蓝色;硬质试管里的白色固体粉末逐渐变成黑色;铜网没有明显的颜色变化.当白色固体粉末全部变成黑色粉末时,停止加热,继续通入氮气至硬质试管冷却.
Ⅱ.待冷却后,取适量黑色粉末溶于少量的稀盐酸中,黑色粉末溶解,溶液呈浅绿色,不产生气泡.
Ⅲ.取Ⅱ中的溶液于试管中,滴加酸性高锰酸钾溶液,溶液的紫色褪去.
(4)实验1中,氮气的作用是
(5)证明白色固体粉末中含有+2价铁的实验现象为
属于分解反应的化学方程式:
(6)某同学在上述实验的基础上,增加了一个实验确认白色固体中不含+3价铁,设计的实验可能是

