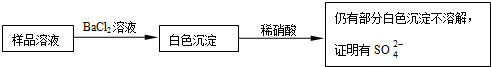
题目内容
某同学设计了如下实验Ⅰ和实验Ⅱ,测定某氯化铁与氯化亚铁的混合物
中铁元素的质量分数x.请按要求回答下列问题:
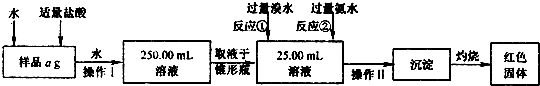
实验Ⅰ:
(1)样品中加入盐酸的作用是.
(2)操作Ⅰ溶液配制过程中所用到的玻璃仪器除烧杯、玻璃棒外,还需要的有(填
仪器名称)______;操作n名称为______.
(3)反应①的离子反应方程式为______.
(4)若坩埚质量是W1g,坩埚与最终灼烧后的固体总质量是W2 g,则样品中铁元素
的质量分数(化简代数式)x1=______
实验Ⅱ:

(5)反应③的离子方程式为______.
(6)若3次平行滴定实验,平均消耗c mol/L KMnO4溶液的体积为d mL,则样品中铁元素的质量分数(化简代数式)x2=______
若样品溶解仍使用盐酸而不改用稀硫酸,则所得样品中铁元素的质量分数将(填“偏大”、“偏小”或“无影响”)______.
(7)你认为实验II的设计不足之处有______.
解:(1)流程中加入盐酸是为了溶解过程中抑制铁离子和亚铁离子的水解,故答案为:抑制铁盐水解;
(2)溶液配制是取用固体在烧杯中溶解,用玻璃棒搅拌,转移到250ml容量瓶中,加水定容,最后用胶头滴管定容,用到的玻璃仪器为250 mL容量瓶、胶头滴管;操作Ⅱ是溶液中得到固体,实验操作是过滤洗涤得到,
故答案为:250 mL容量瓶、胶头滴管;过滤洗涤;
(3)反应①是溴单质氧化亚铁离子的反应,反应的离子方程式为:2Fe2+Br2=2Fe3++2Br-,故答案为:2Fe2+Br2=2Fe3++2Br-;
(4)若坩埚质量是Wg,坩埚与最终灼烧后的固体总质量是W2 g则生成的氧化铁质量为(W2-W1)g,25ml溶液中铁元素的质量=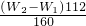 ,250ml中含有铁元素质量
,250ml中含有铁元素质量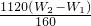 ;所以铁元素质量分数=
;所以铁元素质量分数=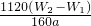 ×100%=
×100%=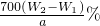 ,故答案为:
,故答案为: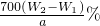 ;
;
(5)反应③是加入M把铁离子还原为亚铁离子,最后用高锰酸钾氧化滴定测定亚铁离子的物质的量计算含量,加入的M为铜,反应的离子方程式是2Fe3++Cu=2Fe2++Cu2+,
故答案为:2Fe3++Cu=2Fe2++Cu2+;
(6)若3次平行滴定实验,平均消耗c mol/L KMnO4溶液的体积为d mL,物质的量为cmol/L×d×10-3L;依据反应的离子方程式,设亚铁离子物质的量为x:
5Fe2++MnO4-+16H+=Mn2++5Fe3++8H2O
5 1
x cd×10-3mol
x=5 cd×10-3mol
250ml溶液中含铁元素物质的量为5 cd×10-2mol
样品中铁元素的质量分数=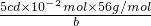 ×100%=
×100%=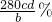 ;
;
若样品溶解仍使用盐酸而不改用稀硫酸,氯离子被高锰酸钾氧化,消耗高锰酸钾物质的量增大,则所得样品中铁元素的质量分数将偏大;
故答案为: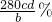 ;偏大;
;偏大;
(7)实验II的设计不足之处是操作过程中Fe2+易被空气中氧气氧化,会导致x偏小;CuCl2溶液的颜色会干扰滴定终点的判断,
故答案为:实验Ⅱ操作过程中Fe2+易被空气中氧气氧化,会导致x偏小;CuCl2溶液的颜色会干扰滴定终点的判断.
分析:(1)测定某氯化铁与氯化亚铁的混合物中铁元素的质量分数x,样品中加入盐酸的作用是抑制铁盐水解;
(2)依据溶液配制步骤和实验过程判断需要的玻璃仪器,操作Ⅱ是溶液中得到沉淀的操作为过滤;
(3)反应①是溴单质氧化亚铁离子的反应;
(4)若坩埚质量是Wg,坩埚与最终灼烧后的固体总质量是W2 g则生成的氧化铁质量为(W2-W1)g,依据氧化铁化学式计算25ml溶液中铁元素质量,换算250ml中含有铁元素质量计算含量;
(5)反应③是加入M把铁离子还原为亚铁离子,最后用高锰酸钾氧化滴定测定亚铁离子的物质的量计算含量;
(6)依据高锰酸钾和亚铁离子反应的离子方程式定量关系计算亚铁离子物质的量,结合溶液体积变化计算原样品含有的铁元素物质的量,得到质量分数;若用盐酸溶液中氯离子也会被高锰酸钾溶液氧化,增大消耗高锰酸钾的物质的量,测定结果偏高;
(7)利用亚铁离子氧化还原滴定实验测定铁元素物质的量,过程中亚铁离子会被空气中氧气氧化产生误差.
点评:本题考查了物质性质的实验探究实验设计和实验操作应用,溶液配制方法步骤,氧化还原滴定的计算应用,实验分析判断是解题关键,题目难度中等.
(2)溶液配制是取用固体在烧杯中溶解,用玻璃棒搅拌,转移到250ml容量瓶中,加水定容,最后用胶头滴管定容,用到的玻璃仪器为250 mL容量瓶、胶头滴管;操作Ⅱ是溶液中得到固体,实验操作是过滤洗涤得到,
故答案为:250 mL容量瓶、胶头滴管;过滤洗涤;
(3)反应①是溴单质氧化亚铁离子的反应,反应的离子方程式为:2Fe2+Br2=2Fe3++2Br-,故答案为:2Fe2+Br2=2Fe3++2Br-;
(4)若坩埚质量是Wg,坩埚与最终灼烧后的固体总质量是W2 g则生成的氧化铁质量为(W2-W1)g,25ml溶液中铁元素的质量=
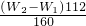 ,250ml中含有铁元素质量
,250ml中含有铁元素质量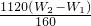 ;所以铁元素质量分数=
;所以铁元素质量分数=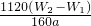 ×100%=
×100%=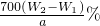 ,故答案为:
,故答案为: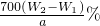 ;
;(5)反应③是加入M把铁离子还原为亚铁离子,最后用高锰酸钾氧化滴定测定亚铁离子的物质的量计算含量,加入的M为铜,反应的离子方程式是2Fe3++Cu=2Fe2++Cu2+,
故答案为:2Fe3++Cu=2Fe2++Cu2+;
(6)若3次平行滴定实验,平均消耗c mol/L KMnO4溶液的体积为d mL,物质的量为cmol/L×d×10-3L;依据反应的离子方程式,设亚铁离子物质的量为x:
5Fe2++MnO4-+16H+=Mn2++5Fe3++8H2O
5 1
x cd×10-3mol
x=5 cd×10-3mol
250ml溶液中含铁元素物质的量为5 cd×10-2mol
样品中铁元素的质量分数=
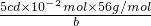 ×100%=
×100%=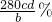 ;
;若样品溶解仍使用盐酸而不改用稀硫酸,氯离子被高锰酸钾氧化,消耗高锰酸钾物质的量增大,则所得样品中铁元素的质量分数将偏大;
故答案为:
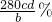 ;偏大;
;偏大;(7)实验II的设计不足之处是操作过程中Fe2+易被空气中氧气氧化,会导致x偏小;CuCl2溶液的颜色会干扰滴定终点的判断,
故答案为:实验Ⅱ操作过程中Fe2+易被空气中氧气氧化,会导致x偏小;CuCl2溶液的颜色会干扰滴定终点的判断.
分析:(1)测定某氯化铁与氯化亚铁的混合物中铁元素的质量分数x,样品中加入盐酸的作用是抑制铁盐水解;
(2)依据溶液配制步骤和实验过程判断需要的玻璃仪器,操作Ⅱ是溶液中得到沉淀的操作为过滤;
(3)反应①是溴单质氧化亚铁离子的反应;
(4)若坩埚质量是Wg,坩埚与最终灼烧后的固体总质量是W2 g则生成的氧化铁质量为(W2-W1)g,依据氧化铁化学式计算25ml溶液中铁元素质量,换算250ml中含有铁元素质量计算含量;
(5)反应③是加入M把铁离子还原为亚铁离子,最后用高锰酸钾氧化滴定测定亚铁离子的物质的量计算含量;
(6)依据高锰酸钾和亚铁离子反应的离子方程式定量关系计算亚铁离子物质的量,结合溶液体积变化计算原样品含有的铁元素物质的量,得到质量分数;若用盐酸溶液中氯离子也会被高锰酸钾溶液氧化,增大消耗高锰酸钾的物质的量,测定结果偏高;
(7)利用亚铁离子氧化还原滴定实验测定铁元素物质的量,过程中亚铁离子会被空气中氧气氧化产生误差.
点评:本题考查了物质性质的实验探究实验设计和实验操作应用,溶液配制方法步骤,氧化还原滴定的计算应用,实验分析判断是解题关键,题目难度中等.

练习册系列答案
相关题目
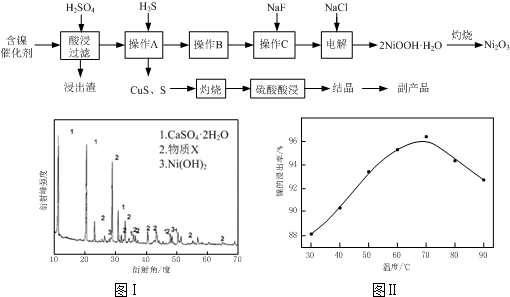
 (2013?闸北区二模)含有硫的化合物在工业生产中应用广泛,回答下列问题:
(2013?闸北区二模)含有硫的化合物在工业生产中应用广泛,回答下列问题: