题目内容
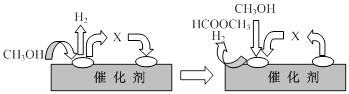
(12分) 1909年化学家哈伯在实验室首次合成了氨。2007年化学家格哈德·埃特尔在哈伯研究所证实了氢气与氮气在固体表面合成氨的反应过程,示意如下图:

(1)图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是______,______。
(2)已知:4NH3(g) + 3O2(g) = 2N2(g) + 6H2O(g); ΔH= - 1266.8 kJ/mol
N2(g) + O2(g) =" 2NO(g)" ; ΔH =" +" 180.5kJ/mol, 氨催化氧化的热化学方程式为__________。
(3)500℃下,在A、B两个容器中均发生合成氨的反应。隔板Ⅰ固定不动,活塞Ⅱ可自由移动。

①当合成氨在容器B中达平衡时,测得其中含有1.0molN2,0.4molH2,0.4molNH3,此时容积为2.0L。则此条件下的平衡常数为____________;保持温度和压强不变,向此容器中通入0.36molN2,平衡将__________(填“正向”、“逆向”或“不”)移动。
②向A、B两容器中均通入xmolN2和ymolH2,初始A、B容积相同,并保持温度不变。若要平衡时保持N2在A、B两容器中的体积分数相同,则x与y之间必须满足的关系式为____。

(1)图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是______,______。
(2)已知:4NH3(g) + 3O2(g) = 2N2(g) + 6H2O(g); ΔH= - 1266.8 kJ/mol
N2(g) + O2(g) =" 2NO(g)" ; ΔH =" +" 180.5kJ/mol, 氨催化氧化的热化学方程式为__________。
(3)500℃下,在A、B两个容器中均发生合成氨的反应。隔板Ⅰ固定不动,活塞Ⅱ可自由移动。

①当合成氨在容器B中达平衡时,测得其中含有1.0molN2,0.4molH2,0.4molNH3,此时容积为2.0L。则此条件下的平衡常数为____________;保持温度和压强不变,向此容器中通入0.36molN2,平衡将__________(填“正向”、“逆向”或“不”)移动。
②向A、B两容器中均通入xmolN2和ymolH2,初始A、B容积相同,并保持温度不变。若要平衡时保持N2在A、B两容器中的体积分数相同,则x与y之间必须满足的关系式为____。
(14分)
(1)N2、H2被吸附在催化剂表面,(2分)在催化剂表面N2、H2中化学键断裂(2分)
(2)4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ΔH=-905.8kJ/mol(3分)
(3)10(2分) 逆向(2分) x=y (3分)
(1)N2、H2被吸附在催化剂表面,(2分)在催化剂表面N2、H2中化学键断裂(2分)
(2)4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ΔH=-905.8kJ/mol(3分)
(3)10(2分) 逆向(2分) x=y (3分)
试题分析:(1)氮气、氢气在催化剂表面合成氨反应过程的顺序为:图①氮气分子和氢气分子向催化剂表面靠近,图②氮气和氢气吸附在催化剂的表面,图③在催化剂的作用下分解成氢原子和氮原子,在催化剂表面N2、H2中的化学键断裂。
(2)①4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1266.8kJ?mol-1;
②N2(g) + O2(g) = 2NO(g) ΔH =" +" 180.5kJ/mol;
根据盖斯定律①+2×②可得:4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=(-1266.8kJ?mol-1+2×180.5kJ?mol-1)=-905.8kJ/mol,可写出热化学方程式。
(3)①N2、H2、NH3的平衡浓度分别为:0.5mol?L?1、0.2mol?L?1、o.2mol?L?1,则平衡常数K=0.22÷(0.5×0.23)=10;保持温度和压强不变,向此容器中通入0.36molN2,气体总物质的量为1.0mol+0.4mol+0.4mol+0.36mol=2.16mol,体积与物质的量成正比,则体积为2L×2.16mol/1.8mol=2.4L,则Q=(0.4/2.4)2÷[1.36/2.4×(0.4/2.4)3]=10.6>K,则平衡将向逆向移动;设转化率为a,根据三段式可得:
N2 + 3H2
 2NH3
2NH3 起始物质的量(mol) x y 0
转化物质的量(mol) ax 3ax 2ax
平衡物质的量(mol) x-ax y-3ax 2ax
则N2的体积分数为x(1-a)/(x+y-2ax),当x=y时,上式为定值=50%,所以若要平衡时保持N2在A、B两容器中的体积分数相同,则x与y之间必须满足的关系式为x=y。

练习册系列答案
相关题目
 2HCl,下列说法正确的是
2HCl,下列说法正确的是
 2S03(g)的能量变化,该反应的ΔH=A一BkJ/mol
2S03(g)的能量变化,该反应的ΔH=A一BkJ/mol
 反应生成3 mol Ag2O(s)时放出的热量为
反应生成3 mol Ag2O(s)时放出的热量为
 反应生成4 mol Ag(s)时吸收的热量为62.2 kJ,试根据题给数据判断O3转化为O2是________(填“放热”或“吸热”)反应。
反应生成4 mol Ag(s)时吸收的热量为62.2 kJ,试根据题给数据判断O3转化为O2是________(填“放热”或“吸热”)反应。

 HCOOCH3(g)+2H2(g) △H>0
HCOOCH3(g)+2H2(g) △H>0