题目内容
 (2013?保定一模)某校化学兴趣小组设计了如下实验装置(图中部分夹持仪器已略去)来测 定某铁碳合金中铁的质量分数,并探究铁与浓硫酸的反应.请回答下列问题:
(2013?保定一模)某校化学兴趣小组设计了如下实验装置(图中部分夹持仪器已略去)来测 定某铁碳合金中铁的质量分数,并探究铁与浓硫酸的反应.请回答下列问题:(1)mg铁碳合金中加入过量浓硫酸,未点燃酒精灯前,A、B均无明显现彖,其原 因是①
常温下Fe在浓硫酸中钝化
常温下Fe在浓硫酸中钝化
②碳不与浓硫酸反应
碳不与浓硫酸反应
(2)点燃酒精灯,可观察到B中的现象是
品红溶液褪色
品红溶液褪色
C 的作用是除去二氧化硫并检验二氧化硫以除尽
除去二氧化硫并检验二氧化硫以除尽
(3)待A中不再逸出气体时,停止加热,拆下E并称重,E增重bg.则铢碳合金 中铁的质量分数为
1-
| 3b |
| 11m |
1-
(写表达式).| 3b |
| 11m |
(4)兴趣小组使用设计的如图实验装置,操作正确,且每一个反应均完全,仍然发现所测得的铁碳合金中铁的质量分数偏低,其主要原因是
干燥管中的碱石灰能够吸收空气中CO2、H2O等
干燥管中的碱石灰能够吸收空气中CO2、H2O等
.(5)若反应一段时间后,用滴管吸取A中的溶液滴入到适量水中作为试样,试样中所含金属离子的成分有以下三种可能:Ⅰ:只含有Fe3+;Ⅱ:只含有Fe2+;Ⅲ:
既有Fe2+,又有Fe3+
既有Fe2+,又有Fe3+
验证Ⅲ的实验方法是既有Fe2+,又有Fe3+;取试样少许与试管中,先滴加少量的硫氰化钾溶液,振荡后溶液显示红色证明有Fe3+;再取少许试样与试管中,滴加少量的酸性KMnO4溶液,若浅红色褪去,证明溶液中含有Fe2+
既有Fe2+,又有Fe3+;取试样少许与试管中,先滴加少量的硫氰化钾溶液,振荡后溶液显示红色证明有Fe3+;再取少许试样与试管中,滴加少量的酸性KMnO4溶液,若浅红色褪去,证明溶液中含有Fe2+
.分析:(1)根据常温下Fe在浓硫酸中钝化,碳不与浓硫酸反应进行解答;
(2)加热条件下,Fe、碳都与浓硫酸反应,碳与浓硫酸反应生成二氧化硫、二氧化碳与水,根据二氧化硫具有漂白性判断使品红溶液颜色变化;二氧化硫具有还原性,可以被酸性高锰酸钾氧化二除去,根据颜色变化确定二氧化硫是否除尽;
(3)根据碳原子守恒计算出合金中含有碳的质量,再计算出合金中铁的质量分数;
(4)E中所装试剂为碱石灰,可吸收空气中CO2、H2O使测定二氧化碳的质量增大;
(5)根据铁与浓硫酸反应,铁可能被氧化成Fe3+或Fe2+完成假设Ⅲ;先使用硫氰化钾检验铁离子,然后使用高锰酸钾溶液检验亚铁离子.
(2)加热条件下,Fe、碳都与浓硫酸反应,碳与浓硫酸反应生成二氧化硫、二氧化碳与水,根据二氧化硫具有漂白性判断使品红溶液颜色变化;二氧化硫具有还原性,可以被酸性高锰酸钾氧化二除去,根据颜色变化确定二氧化硫是否除尽;
(3)根据碳原子守恒计算出合金中含有碳的质量,再计算出合金中铁的质量分数;
(4)E中所装试剂为碱石灰,可吸收空气中CO2、H2O使测定二氧化碳的质量增大;
(5)根据铁与浓硫酸反应,铁可能被氧化成Fe3+或Fe2+完成假设Ⅲ;先使用硫氰化钾检验铁离子,然后使用高锰酸钾溶液检验亚铁离子.
解答:解:(1)常温下Fe在浓硫酸中钝化,碳不与浓硫酸反应,没有二氧化硫生成,故A、B均无明显现象,
故答案为:常温下Fe在浓硫酸中钝化;碳不与浓硫酸反应;
(2)加热条件下,Fe、碳都与浓硫酸反应,碳与浓硫酸反应生成二氧化硫、二氧化碳与水,反应方程式为:C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O,由于二氧化硫具有漂白性,所以B装置中品红溶液褪色;由装置可知,实验是通过测定E装置碱石灰增重,测定二氧化碳的质量,进而测定铁的含量,碱石灰可以吸收二氧化硫,二氧化硫具有还原性,可以被酸性高锰酸钾氧化二除去,根据颜色变化确定二氧化硫是否除尽,故C的作用是除去二氧化硫并检验二氧化硫以除尽,
故答案为:品红溶液褪色;除去二氧化硫并检验二氧化硫以除尽;
(3)称取mg铁碳合金,加入过量浓硫酸,加热待A中不再逸出气体时,停止加热,拆下E装置并称重,E增重bg,则生成二氧化碳的质量为bg,根据质量守恒定律,则mg铁碳合金中含碳元素的质量为
×12g/mol=
g,则含铁的质量为mg-
g,铁的质量分数为:
=1-
,
故答案为:1-
;
(4)由于装置E中所装试剂为碱石灰,碱石灰能够吸收空气中CO2、H2O等,使测定二氧化碳的质量增大,测得的铁碳合金中铁的质量分数偏低,
故答案为:干燥管中的碱石灰能够吸收空气中CO2、H2O等;
(5)铁与浓硫酸反应,铁可能被氧化成Fe3+或Fe2+,试样中所含金属离子的成分有以下三种可能:只含有Fe3+;只含有Fe2+;既有Fe2+,又有Fe3+,
检验假设Ⅲ的方法为:取试样少许与试管中,先滴加少量的硫氰化钾溶液,振荡后溶液显示红色证明有铁离子;再取少许试样与试管中,滴加少量的酸性高锰酸钾溶液,若浅红色褪去,证明溶液中含有亚铁离子,
故答案为:既有Fe2+,又有Fe3+;取试样少许与试管中,先滴加少量的硫氰化钾溶液,振荡后溶液显示红色证明有Fe3+;再取少许试样与试管中,滴加少量的酸性KMnO4溶液,若浅红色褪去,证明溶液中含有Fe2+.
故答案为:常温下Fe在浓硫酸中钝化;碳不与浓硫酸反应;
(2)加热条件下,Fe、碳都与浓硫酸反应,碳与浓硫酸反应生成二氧化硫、二氧化碳与水,反应方程式为:C+2H2SO4(浓)
| ||
故答案为:品红溶液褪色;除去二氧化硫并检验二氧化硫以除尽;
(3)称取mg铁碳合金,加入过量浓硫酸,加热待A中不再逸出气体时,停止加热,拆下E装置并称重,E增重bg,则生成二氧化碳的质量为bg,根据质量守恒定律,则mg铁碳合金中含碳元素的质量为
| bg |
| 44g/mol |
| 3b |
| 11 |
| 3b |
| 11 |
mg-
| ||
| mg |
| 3b |
| 11m |
故答案为:1-
| 3b |
| 11m |
(4)由于装置E中所装试剂为碱石灰,碱石灰能够吸收空气中CO2、H2O等,使测定二氧化碳的质量增大,测得的铁碳合金中铁的质量分数偏低,
故答案为:干燥管中的碱石灰能够吸收空气中CO2、H2O等;
(5)铁与浓硫酸反应,铁可能被氧化成Fe3+或Fe2+,试样中所含金属离子的成分有以下三种可能:只含有Fe3+;只含有Fe2+;既有Fe2+,又有Fe3+,
检验假设Ⅲ的方法为:取试样少许与试管中,先滴加少量的硫氰化钾溶液,振荡后溶液显示红色证明有铁离子;再取少许试样与试管中,滴加少量的酸性高锰酸钾溶液,若浅红色褪去,证明溶液中含有亚铁离子,
故答案为:既有Fe2+,又有Fe3+;取试样少许与试管中,先滴加少量的硫氰化钾溶液,振荡后溶液显示红色证明有Fe3+;再取少许试样与试管中,滴加少量的酸性KMnO4溶液,若浅红色褪去,证明溶液中含有Fe2+.
点评:本题考查了探究物质的组成方法、实验方案的设计,题目难度较大,涉及了实验方案的设计的评价、离子检验、铁质量分数的计算等知识,注意熟记常见物质的性质或变化规律,根据给出的实验设计方案,进行实验、分析和探究,并通过观察、记录和分析的实验现象,来验证该物质的性质或变化规律,该类试题侧重对学生实验答题能力的培养和方法与技巧的指导和训练,有利于提高学生的实验设计能力和应试能力,提升学生的学科素养.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 H2SiO3+2OH-(或SiO32-+H2O
H2SiO3+2OH-(或SiO32-+H2O HSiO3-+OH-,HSiO3-+H2O
HSiO3-+OH-,HSiO3-+H2O H2SiO3+OH-,AlO2-+H2O
H2SiO3+OH-,AlO2-+H2O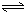 Al(OH)3+OH-),降低pH值有利于平衡向正反应方向移动,当pH调到7~8时,使它们水解完全
Al(OH)3+OH-),降低pH值有利于平衡向正反应方向移动,当pH调到7~8时,使它们水解完全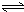 Cr2O72-+H2O
Cr2O72-+H2O