题目内容
反应Fe + H2SO4 == FeSO4 + H2↑的能量变化趋势,如下图所示:
(1)该反应为 反应(填“吸热”或“放热”)
(2)若要使该反应的反应速率加快,下
![]() 列措施可行的是 (填字母) 反应物总能量
列措施可行的是 (填字母) 反应物总能量
a、改铁片为铁粉
b、改稀H2SO4为98%的浓H2SO4
![]()
![]() c、升高温度
c、升高温度
(3)若将上述反应设计成原电池,铜为 生成物总能量
原电池某一极材料,则铜为 极(填“正”或“负”)。铜片上产生的现象为 ,该极上发生的电极反应为 ,外电路中电子由 极(填“正”或“负”下同)向 移动。
(1)放热 (2)正 (3)有气泡冒出 2H++2e-=H2↑ 负 正

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
化学方程式可简明地体现元素及其化合物的性质。已知:
氧化还原反应:
FeCl3+H2S=FeCl2+S;PbO2+4HCl=PbCl2+Cl2↑+2H2O
2Fe(OH)2+Cl2+2KOH=2Fe(OH)3+2KCl;Cl2+2KOH=KCl+KClO+H2O
水溶液中的复分解反应:(Se元素的原子序数为34)
CuSO4+H2S=CuS↓+H2SO4;H2SeO4+2NaN3=Na2SeO4+2HN3;HN3+Na2S=NaN3+H2S
热分解反应:
BaCO3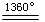 BaO+CO2↑;MgCO3
BaO+CO2↑;MgCO3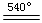 MgO+ CO2↑;CuCO3
MgO+ CO2↑;CuCO3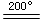 CuO+ CO2↑
CuO+ CO2↑
下列说法不正确的是
| A.氧化性(酸性溶液):PbO2>Fe3+>S |
| B.还原性(碱性溶液):Fe(OH)2>KCl>Cl2 |
| C.酸性(水溶液):H2S>H2SO4>H2SeO4>HN3 |
| D.热稳定性:CaCO3>FeCO3>Ag2CO3 |
 BaO+CO2↑;MgCO3
BaO+CO2↑;MgCO3 MgO+
CO2↑;CuCO3
MgO+
CO2↑;CuCO3 CuO+
CO2↑
CuO+
CO2↑